Phương trình hóa học là 1 trong những bước căn bản đầu tiên các bạn cần tiến hành nếu mong mỏi giải giỏi một bài bác tập hóa học. Để học cách cân bằng phương trình hóa học lớp 8 nhanh chúng ta cần chú ý những kim chỉ nan trọng tâm mà shop chúng tôi sắp đề cậpsau đây!
I. Định nghĩa
Phương trình hóa học là bội phản ứng xảy ra giữa nhì hay các chất dưới tác động của những chất xúc tác haymôi trường làm phản ứng để tạo ra các sản phẩm khác.
Bạn đang xem: Cân bằng hóa học lớp 8
Ví dụ:(Ba
Cl_2 + Fe_2(SO4)_3
ightarrow Ba
SO_4 + Fe
Cl_3)
II. Các dạng cân bằng phương trình chất hóa học lớp 8
1. Mẹo cân đối phương trình hóa học lớp 8 cơ bản
Phương pháp nguyên tử nguyên tố:
Đây là một phương thức khá đối chọi giản. Khi cân đối ta vậy ý viết những đơn chất khí ((H_2, O_2, Cl_2, N_2…)) bên dưới dạng nguyên tử cá biệt rồi lập luận qua một vài bước.
Ví dụ: thăng bằng phản ứng(P + O_2 ightarrow P_2O_5)
Ta viết: (P + O ightarrow P_2O_5)
Để chế tạo ra thành 1 phân tử P2O5cần 2 nguyên tử p. Và 5 nguyên tử O:
(2P + 5O ightarrow P_2O_5)
Nhưng phân tử oxi bao giờ cũng có hai nguyên tử, do đó nếu đem 5 phân tử oxi có nghĩa là số nguyên tử oxi tăng lên gấp 2 thì số nguyên tử p. Và số phân tử P2O5cũng tạo thêm gấp 2, tức 4 nguyên tử phường và 2 phân tử P2O5.
Vì vậy: (4P + 5O_2 ightarrow 2P_2O_5)
Phương pháp sử dụng hóa trị:
Áp dụng phương thức này phải tiến hành quá trình sau:
+ xác minh hóa trị tác dụng:
II – I III – II II-II III – I
(Ba
Cl_2 + Fe_2(SO4)_3
ightarrow Ba
SO_4 + Fe
Cl_3)
Hóa trị tính năng lần lượt tự trái qua nên là:
II – I – III – II – II – II – III – I
Tìm bội số chung nhỏ dại nhất của các hóa trị tác dụng:
BSCNN(1, 2, 3) = 6
+ đem BSCNN chia cho những hóa trị ta được các hệ số:
6/II = 3, 6/III = 2, 6/I = 6
Thay vào làm phản ứng:
(3Ba
Cl_2 + Fe_2(SO_4)_3
ightarrow 3Ba
SO_4 + 2Fe
Cl_3)
Đặt thông số cho từng hóa học thamgia với sản phẩm
Ví dụ: (P + O_2 ightarrow P_2O_5)
+ Đặt hệ số để cân nặng bằng: (2P + dfrac52O_2 ightarrow P_2O_5)
+ Nhân những hệ số với mẫu số chung bé dại nhất nhằm khử những phân số. Ỏ trên đây nhân 2.
(2.2P + 2.dfrac52O_2 ightarrow 2P_2O_5)
hay (4P + 5O_2 ightarrow 2P_2O_5)
2. Mẹo thăng bằng phương trình hóa học lớp 8 nâng cao
Xác định sự biến đổi số oxi hóa:(Fe
S + HNO_3
ightarrow Fe(NO_3)_3 + N_2O + H_2SO4 + H_2O)
(Fe+2 ightarrow Fe^+3)
(S^-2 ightarrow S^+6)
(N^+5 ightarrow N^+1)
(Viết số thoái hóa này phía trên những nguyên tố tương ứng)
Phương pháp lập thăng bởi electron:(Fe^+2 ightarrow Fe^+3 + 1e)
(S^-2 ightarrow S^+6+8e)
(Fe
S
ightarrow Fe^+3 + S^+6 + 9e)
(2N^+5 + 8e ightarrow 2N^+1)
(
ightarrow tất cả 8Fe
S với 9N_2O.)
Tìm các hệ số còn sót lại khi biết những hệ số đến trước
(8Fe
S + 42HNO_3
ightarrow 8Fe(NO_3)_3 + 9N_2O + 8H_2SO_4 + 13H_2O)
(Na
CrO_2 + Br_2 + Na
OH
ightarrow Na_2Cr
O_4 + Na
Br\ Cr
O^2- + 4OH^-
ightarrow Cr
O_4^2- + 2H_2O + 3e imes2\ Br_2 + 2e
ightarrow 2Br^- imes3)
Phương trình ion:
(2Cr
O^2- + 8OH^- + 3Br_2
ightarrow 2Cr
O_4^2- + 6Br^- + 4H_2O)
Phương trình làm phản ứng phân tử:
(2Na
CrO_2 + 3Br_2 + 8Na
OH
ightarrow 2Na_2Cr
O_4 + 6Na
Br + 4H_2O)
III. BT thăng bằng phương trình chất hóa học lớp 8
Bài 1: cân nặng bằng các phương trình sau:
1) Mg
Cl2 + KOH → Mg(OH)2 + KCl2) Cu(OH)2 + HCl → Cu
Cl2 + H2O3) Cu(OH)2 + H2SO4 → Cu
SO4 + H2O4) Fe
O + HCl → Fe
Cl2 + H2O5) Fe2O3 + H2SO4 → Fe2 (SO4)3 + H2O6) Cu(NO3)2 + Na
OH → Cu(OH)2 + Na
NO37) p. + O2 → P2O58) N2 + O2 → NO9) NO + O2 → NO210) NO2 + O2 + H2O → HNO3
Bài 2: mang đến sơ đồ của các phản ứng sau:
a) na + O2 → Na2O b) P2O5 + H2O → H3PO4c) Hg
O → Hg + O2 d) Fe(OH)3 → Fe2O3 + H2O
Lập PT chất hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của những chất trong những phản ứng?
Trên đây là cục bộ kiến thức shop chúng tôi muốn chia sẻ về những dạng cơ bạn dạng và cáchcân bằng phương trình hóa học khó lớp 8, cùng học vui chúc chúng ta đạt lấy điểm số cao!
Phương trình chất hóa học là gì? cân đối phương trình hóa học lớp 8 cầm cố nào cho chủ yếu xác? chắc hẳn rằng đây chính là thắc mắc của phần lớn chúng ta lớp 8 khi “chạm” cho chương phản bội ứng hóa học. Mỗi một chủ thể kiến thức sẽ sở hữu được điểm thú vị riêng của nó, tạo thành nền tảng quan trọng đặc biệt để các bạn học tốt các năm học tiếp theo.
Ở bài viết này, gia sư Thành Tâm sẽ lần lượt đáp án và hướng dẫn các bạn cách cân bằng phương trình một cách chi tiết nhất, dễ nắm bắt nhất. Hãy cùng đọc và xem thêm thôi nào? chúng sẽ không quá khó đâu nè!
Nội dung bài xích viết ẨN
1. Phương trình chất hóa học là gì?
2. Nguyên tắc thăng bằng phương trình hóa học lớp 8
3. Các bước cân bởi phương trình hóa học
4.
4.1. Cân bằng theo phương pháp truyền thống
4.2. Thăng bằng phương trình hóa học bằng cách thức đại số
4.3. Thăng bằng phương trình bằng phương thức bảo toàn electron
Phương trình hóa học là gì?
Phương trình hóa học hay có cách gọi khác là một phương trình tình tiết phản ứng hóa học. Phương trình hóa học là 1 phương trình gồm bao gồm hai vế nối cùng với nhau do dấu mũi thương hiệu từ trái quý phái phải, trong đó:
Vế trái biểu diễn những chất tham gia, vế buộc phải biểu diễn những chất nhận được sau bội phản ứng.Tất cả các chất điều được viết bởi công thức hóa học và gồm những hệ số đặt trước bí quyết hóa học tập để bảo vệ đúng định luật pháp bảo toàn khối lượng.
Nguyên tắc thăng bằng phương trình chất hóa học lớp 8
Để cân bằng đúng phương trình hóa học, các bạn phải nắm được cơ chế cơ bạn dạng sau:
Không bao gồm nguyên tử nào tự xuất hiện hay tự không đủ mà gửi từ hợp hóa học này quý phái hợp chất khác. Bởi thế, số lượng nguyên tử của một thành phần trước với sau phản ứng bởi nhau.
Số lượng nguyên tử của một thành phần trong hóa học tham gia = con số nguyên tử của một yếu tố trong hóa học tạo thành.
Các bước cân bằng phương trình hóa học
Các bạn phải ghi nhớ thiết bị tự quá trình cân bởi phương trình hóa học bên dưới đây. Khi có tác dụng đúng các bước này, các các bạn sẽ cân bằng được các phương trình từ dễ dàng và đơn giản đến phức tạp. Thế thể:
Bước 1: cân bằng nhóm nguyên tử (SO4, NO3, OH, CO3,…)Bước 2: cân bằng nguyên tử HidroBước 3: cân đối nguyên tử OxiBước 4: cân nặng bằng các nguyên tố còn lại. Những cách thức cân bởi phương trình chất hóa học lớp 8
Sau phía trên gia sư lớp 8 của thực tình xin giữ hộ đến các bạn các phương thức cơ phiên bản dùng để cân bằng phương trình như sau:
Cân bởi theo phương thức truyền thống
Bước 1: Viết phương trình đang choBước 2: Viết con số nguyên tử của từng nguyên tố mà chúng ta có sống mỗi mặt của phương trình.Bước 3: Đếm số nguyên tử của những nguyên tố khác Oxi, Hidro ngơi nghỉ vế trái với vế yêu cầu để cân bằng hệ số cho chúng bởi nhau.Bước 4: thăng bằng nguyên tố H và sau cùng là nhân tố OxiVí dụ: sắt + HCl → Fe
Cl2 + H2
Trước làm phản ứng: Fe=1, Cl=1, H=1
Sau làm phản ứng: Fe=1, Cl=2, H=2
Lưu ý: Để nguyên tử Hidro và Oxi cuối cùng.
→ bên phải gồm 2 nguyên tử Fe đề xuất bạn cân đối số 2 nghỉ ngơi Fe
→ bên phải gồm 2 nguyên tử Cl yêu cầu bạn thăng bằng số 2 ở kí hiệu HCl
→ thắt chặt và cố định các chất đã gồm cân bằng, đếm nguyên tử H và xong xuôi phương trình hóa học.
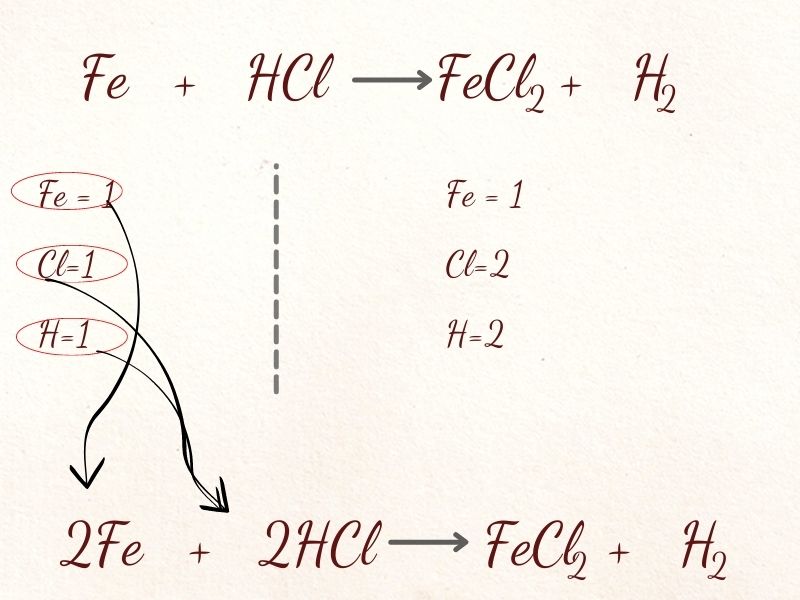
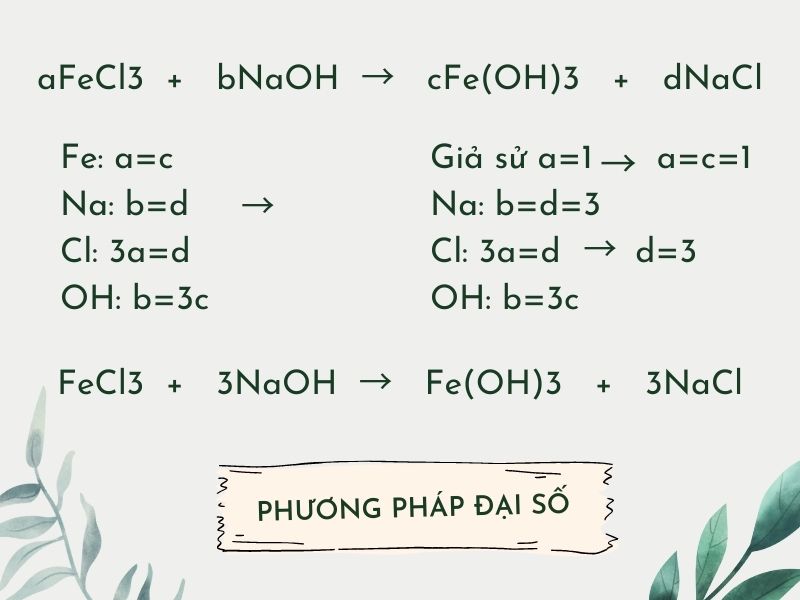
Cân bằng phương trình hóa học bằng phương thức đại số
Bước 1: Viết phương trình theo cam kết hiệu và công thức.
Bước 2: thay thế sửa chữa các chữ số bởi biến số của chúng.
Bước 3: Kiểm tra số lượng các nguyên tố mặt chất phản ứng cũng tương tự bên sản phẩm.
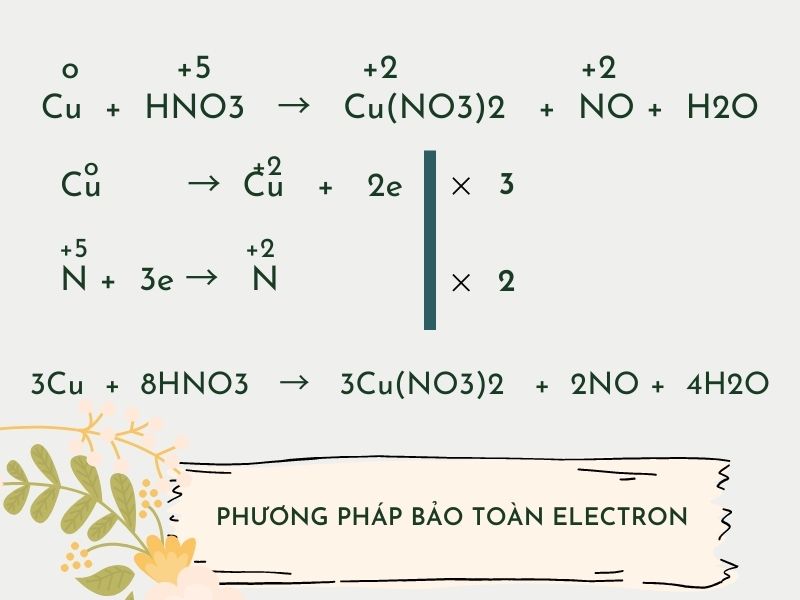
Cân bằng phương trình bằng cách thức bảo toàn electron
Bước 1: xác định số oxi hóa của những chất bao gồm số oxi hóa thay đổi trước và sau bội phản ứng.
Bước 2: cân bằng electron theo nguyên tắc: tổng thể electron nhường = tổng thể electron nhận
Bước 3: Dùng cách thức 1 để xác định các hệ số của các chất.
→ Đây là cách thức dùng để cân bằng các phương trình hóa học phức tạp và giải các bài toán khó.
KẾT LUẬN:
Gia sư hóa lớp 8 mong muốn qua nội dung bài viết này, các bạn sẽ lần lượt đáp án và biết cách cân bằng phương trình hóa học lớp 8. Thật ra, khi chúng ta hiểu được thực chất và nguyên tắc cân đối nguyên tố thì nó sẽ không còn khó như bạn nghĩ đâu nhé! kỹ năng lớp 8 là kiến thức quan trọng, tạo nên nền tảng đặc biệt quan trọng để đoạt được môn hóa trong những năm tiếp theo.
Xem thêm: Top 13+ chibi cảnh sát nhân dân việt nam, các cặp đôi cảnh sát đáng yêu trong tranh chibi
Mọi chi tiết và vướng mắc vui lòng tương tác về số hotline 0374771705 hoặc fanpage nhằm được tư vấn và phía dẫn.