Bài 2: một vài oxit quan tiền trọng
Bài 3: đặc thù hóa học tập của axit
Bài 4: một số axit quan liêu trọng
Bài 5: Luyện tập: đặc thù hóa học của oxit với axit
Bài 6: Thực hành: đặc điểm hóa học của oxit và axit
Bài 7: tính chất hóa học của bazơ
Bài 8: một vài bazơ quan tiền trọng
Bài 9: tính chất hóa học của muối
Bài 10: một số trong những muối quan tiền trọng
Bài 11: Phân bón hóa học
Bài 12: mối quan hệ giữa những loại hợp chất vô cơ
Bài 13: rèn luyện chương 1: các loại hợp chất vô cơ
Bài 14: Thực hành: tính chất hóa học tập của bazơ cùng muối
Mục lục
Xem toàn bộ tài liệu Lớp 9: tại đâyXem cục bộ tài liệu Lớp 9
: trên đâyGiải bài bác Tập chất hóa học 9 – bài xích 2: một số oxit đặc biệt giúp HS giải bài xích tập, cung ứng cho những em một hệ thống kiến thức và hiện ra thói quen học tập làm việc khoa học, làm căn nguyên cho vấn đề phát triển năng lực nhận thức, năng lượng hành động:
Bài 1: Bằng phương pháp hóa học tập nào rất có thể nhận biết được từng chất trong những dãy chất sau:a) Hai chất rắn white color là Ca
O và Na2O.
Bạn đang xem: Hóa 9 bài 2: một số oxit quan trọng
b) Hai hóa học khí ko màu là CO2 cùng O2
Viết phần đông phương trình phản ứng hóa học.
Lời giải:
a) mang một ít mỗi chất cho chức năng với nước, tiếp đến đem lọc, nước lọc của những dung dịch này được thử bằng khí CO2 hoặc dung dịch Na2CO3. Nếu tất cả kết tủa white thì chất ban sơ là Ca
O, nếu không tồn tại kết tủa thì chất ban đầu là Na2O. Phương trình phản bội ứng :
Ca
O + H2O → Ca(OH)2
Ca(OH)2 + CO2 → Ca
CO3 ↓ + H2O
Hoặc Ca(OH)2 + Na2CO3 → Ca
CO3 ↓ + 2Na
OH
Na2O + H2O → 2Na
OH
2Na
OH + CO2 → Na2CO3 + H2O.
b) Sục hai chất khí ko màu vào nhị ống nghiệm đựng nước vôi Ca(OH)2 trong. Ống nghiệm như thế nào bị vẩn đục, thì khí lúc đầu là CO2, khí còn lại là O2.
PTPỨ: Ca(OH)2 + CO2 → Ca
CO3↓ + H2O
A. Can xi oxit
Bài 2: Hãy nhận biết từng cặp chất trong mỗi nhóm chất sau bằng phương pháp hóa học:a) Ca
O, Ca
CO3
b) Ca
O, Mg
O
Viết các phương trình bội nghịch ứng hóa học.
Lời giải:
Nhận biết từng chất trong mỗi nhóm chất sau:
a) Ca
O cùng Ca
CO3.
Lẫy mẫu mã thử từng hóa học cho từng mẫu thử vào nước khuấy đều.
Mẫu nào chức năng mạnh cùng với H2O là Ca
O.
Mẫu còn sót lại không tan trong nước là Ca
CO3.
PTPỨ: Ca
O + H2O → Ca(OH)2
b) Ca
O cùng Mg
O.
Lấy mẫu thử từng hóa học và cho công dụng với H2O khuấy đều.
Mẫu nào bội phản ứng táo bạo với H2O là Ca
O.
Mẫu sót lại không tính năng với H2O là Mg
O.
PTPỨ: Ca
O + H2O → Ca(OH)2
A. Canxi oxit
Bài 3: 200ml dung dịch HCl gồm nồng độ 3,5mol/lit hòa tan trọn vẹn 20g tất cả hổn hợp CuO và Fe2O3.
a) Viết những phương trình phản ứng hóa học.
b) Tính cân nặng của từng oxit bazơ bao gồm trong tất cả hổn hợp ban đầu.
Lời giải:
VHCl = 200ml = 0,02 lít
n
HCl = 3,5 x 0,02 = 0,7 mol.
Gọi x, y là số mol của Cu
O với Fe2O3.
a) Phương trình phản ứng hóa học :
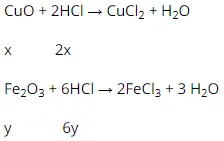
b) từ phương trình phản nghịch ứng bên trên ta có:
n
HCl (1) = 2.n
CuO = 2x mol
n
HCl (2) = 6.n
Fe2O3 = 6y mol
⇒ n
HCl = 2x + 6y = 0,7 mol (∗)
m
CuO = (64 + 16).x = 80x g; m
Fe2O3 = (56.2 + 16.3).y = 160y g
Theo bài: mhỗn hợp = m
CuO + m
Fe2O3 = 80x + 160y = 20g
⇒ x + 2y = 0,25 ⇒ x = 0,25 – 2y (∗∗)
Thay x vào (∗) ta được: 2(0,25 – 2y) + 6y = 0,7
⇒ 0,5 – 4y + 6y = 0,7 ⇒ 2y = 0,2 ⇒ y = 0,1 mol
Thay y vào (∗∗) ta được: x = 0,25 – 2.0,1 = 0,05 mol
⇒ m
CuO = 0,05 x 80 = 4g
m
Fe2O3 = 0,1 x 160 = 16g
(Lưu ý: thanh lịch kì 2 các bạn mới học tập về Hệ phương trình đề nghị bài này sẽ không giải theo cách đem đến hệ phương trình.)
A. Can xi oxit
Bài 4: Biết 2,24 lit khí CO2 (đktc) tính năng vừa đủ với 200ml dung dịch Ba(OH)2 thành phầm sinh ra là BaCO3 và H2O.
a) Viết phương trình bội phản ứng.
b) Tính độ đậm đặc mol của dung dịch Ba(OH)2 sẽ dùng.
c) Tính cân nặng chất kết tủa thu được.
Lời giải:
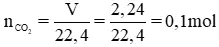
a) Phương trình làm phản ứng hóa học:
CO2 + Ba(OH)2 → Ba
CO3 ↓ + H2O
b) phụ thuộc vào phương trình phản ứng trên ta nhận thấy:
n
Ba(OH)2 = n
CO2 = 0,1 mol, VBa(OH)2 = 200ml = 0,2 lít
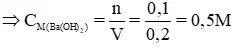
c) phụ thuộc vào phương trình làm phản ứng trên ta có:
n
BaCO3 = n
CO2 = 0,1 mol.
⇒ m
BaCO3 = 0,1 x 197 = 19,7 g.
A. Canxi oxit
Bài 1: Viết phương trình hóa học mang đến mỗi thay đổi sau: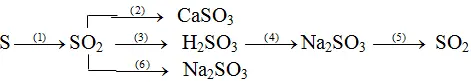
Lời giải:
(1) S + O2 → SO2
(2) SO2 + Ca
O → Ca
SO3
Hay SO2 + Ca(OH)2(dd) → Ca
SO3 + H2O
(3) SO2 + H2O → H2SO3
(4) H2SO3 + 2Na
OH → Na2SO3 + 2H2O
Hoặc H2SO3 + Na2O → Na2SO3 + H2O
(5) Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
Không buộc phải dùng bội phản ứng:
Na2SO3 + 2HCl → 2Na
Cl + SO2 ↑ + H2O bởi vì HCl dễ cất cánh hơi yêu cầu khí SO2 thu được sẽ không tinh khiết.
(6) SO2 + 2Na
OH → Na2SO3 + H2O
Hoặc SO2 + Na2O → Na2SO3
B. Lưu huỳnh đioxit
Bài 2: Hãy nhận ra từng cặp chất trong mỗi nhóm chất sau bằng phương pháp hóa học:a) Ca
O, Ca
CO3
b) Ca
O, Mg
O
Viết những phương trình bội nghịch ứng hóa học.
Lời giải:
Nhận biết từng chất trong những nhóm chất sau:
a) Ca
O với Ca
CO3.
Lẫy mẫu mã thử từng chất cho từng chủng loại thử vào nước khuấy đều.
Mẫu nào tính năng mạnh cùng với H2O là Ca
O.
Mẫu còn lại không chảy trong nước là Ca
CO3.
PTPỨ: Ca
O + H2O → Ca(OH)2
b) Ca
O cùng Mg
O.
Lấy chủng loại thử từng hóa học và cho tác dụng với H2O khuấy đều.
Mẫu nào phản nghịch ứng mạnh mẽ với H2O là Ca
O.
Mẫu còn lại không tính năng với H2O là Mg
O.
PTPỨ: Ca
O + H2O → Ca(OH)2
A. Can xi oxit
Bài 3: bao hàm khí độ ẩm (khí bao gồm lẫn khá nước): cacbon đioxit, hiđro, sulfur đioxit. Khí nào rất có thể làm khô bằng canxi oxit? Giải thích.Lời giải:
+ đề xuất hút ẩm được.
+ Không tính năng với chất được gia công khô.
Ca
O có tình hút độ ẩm (hơi nước) tạo ra thành Ca(OH)2, đồng thời là một trong oxit bazơ (tác dụng cùng với oxit axit). Do đó Ca
O chỉ dùng làm khô những khí ẩm là hiđro ẩm, oxi ẩm.
B. Diêm sinh đioxit
Bài 4: bao hàm chất khí sau: CO2, H2, O2, SO2, N2. Hãy cho thấy thêm chất nào có đặc thù sau:a) Nặng rộng không khí.
b) khối lượng nhẹ hơn khống khí.
c) Cháy được trong ko khí.
d) chức năng với nước tạo nên thành hỗn hợp axit.
e) có tác dụng đục nước vôi trong.
g) Đổi màu giấy quỳ tím ẩm thành đỏ.
Lời giải:
a) rất nhiều khí nặng hơn không khí: CO2, O2, SO2.
Vì Mkk = 29 g/mol.
MCO2 = 12 + 16.2 = 44 g/mol
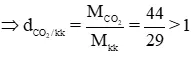
⇒ CO2 nặng hơn kk
Tương tự: MO2 = 16.2 = 32 g/mol , MSO2 = 32 + 16.2 = 64g/mol
b) hầu như khí nhẹ nhàng hơn không khí: H2, N2.
Mkk = 29 g/mol.
MH2 = 1.2 = 2 g/mol
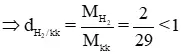
⇒ H2 nhẹ nhàng hơn kk
Tương tự: MN2 = 14.2 = 28g/mol
c) đều khí cháy được trong không khí: H2.
2H2 + O2 → 2H2O
d) hồ hết khí chức năng với nước chế tạo thành hỗn hợp axit: CO2, SO2.
PTHH: CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
e) hầu như khí có tác dụng đục nước vôi trong: CO2, SO2.
Ca(OH)2 + CO2 → Ca
CO3 ↓ + H2O
Ca(OH)2 + SO2 → Ca
SO3 ↓ + H2O
g) phần nhiều khí làm chuyển màu sắc quỳ tím ẩm thành đỏ: CO2, SO2.
Quỳ tím ẩm ⇒ xảy ra phản ứng với nước tạo ra axit làm quỳ tím gửi đỏ
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
B. Lưu hoàng đioxit
Bài 5: Khí lưu huỳnh đioxit được chế tác thành từ cặp chất nào sau đây:a) K2SO3 và H2SO4.
b) K2SO4 và HCl.
c) Na2SO3 với Na
OH.
d) Na2SO4 với Cu
Cl2.
e) Na2SO3 với Na
Cl.
Lời giải:
Khí SO2 được chế tác thành trường đoản cú cặp chất:
K2SO3 + H2SO4 → K2SO4 + SO2 ↑ + H2O.
B. Lưu hoàng đioxit
Bài 6: Dẫn 112ml khí SO2 (đktc) trải qua 700ml dung dịch Ca(OH)2 bao gồm nồng độ 0,01 M, sản phẩm là muối can xi sunfit.a) Viết phương trình phản nghịch ứng hóa học.
Giải Hoá học tập 9 bài xích 2: một số trong những oxit quan tiền trọng là tư liệu vô cùng có lợi giúp những em học sinh lớp 9 có thêm nhiều gợi nhắc tham khảo nhằm giải các câu hỏi trang 9, 11 chương 1 được nhanh lẹ và dễ dàng hơn.
Giải Hóa 9 bài bác 2 được trình bày rõ ràng, cẩn thận, dễ dàng hiểu nhằm mục đích giúp học tập sinh mau lẹ biết cách làm bài, đôi khi là bốn liệu có ích giúp giáo viên thuận lợi trong bài toán hướng dẫn học viên học tập. Vậy sau đây là nội dung cụ thể Giải bài tập Hóa 9 bài 2 một vài oxit quan liêu trọng, mời các bạn cùng thiết lập tại đây.
Giải Hoá 9 bài xích 2: một số trong những oxit quan lại trọng
Lý thuyết Hóa 9 bài bác 2: một vài oxit quan liêu trọngGiải bài bác tập Hóa 9 bài xích 2 trang 9Giải bài bác tập Hóa 9 bài xích 2 trang 11
Lý thuyết Hóa 9 bài 2: một số oxit quan trọng
I. Can xi oxit
- cách làm hóa học tập là Ca
O, tên thường thì là vôi sống, là chất rắn, màu sắc trắng.
1. đặc điểm hóa học
Ca
O có không thiếu thốn tính hóa chất của oxit bazơ.
a) tính năng với nước: Ca
O (r) + H2O (l) → Ca(OH)2 (r)
Phản ứng của Ca
O cùng với nước call là phản ứng tôi vôi, phản nghịch ứng này tỏa nhiều nhiệt.
Chất Ca(OH)2 sản xuất thành hotline là vôi tôi, là chất rắn màu trắng, ít tan trong nước, phần tan tạo thành thành hỗn hợp bazơ còn được gọi là nước vôi trong.
Ca
O bao gồm tính hút ẩm mạnh phải được dùng để triển khai khô nhiều chất.
b) công dụng với axit chế tác thành muối cùng nước.
Ví dụ:
Ca
O + 2HCl → Ca
Cl2 + H2O
Nhờ tính chất này, Ca
O được dùng làm khử chua đất trồng trọt, cách xử lý nước thải của tương đối nhiều nhà trang bị hóa chất, …
c) tác dụng với oxit axit tạo ra thành muối.
Vì vậy Ca
O vẫn giảm unique nếu lưu lại lâu ngày vào tự nhiên.
2. Ứng dụng của can xi oxit
Ca
O có những ứng dụng đa số sau đây:
- phần lớn canxi oxit được dùng trong công nghiệp luyện kim và làm vật liệu cho công nghiệp hóa học.
- kế bên ra, canxi oxit còn được dùng làm khử chua khu đất trồng trọt, up load nước thải công nghiệp, ngay cạnh trùng, khử nấm, khử độc môi trường,…
- canxi oxit tất cả tính hút độ ẩm mạnh đề nghị được dùng để triển khai khô các chất.
3. Sản xuất can xi oxit vào công nghiệp
Nguyên liệu để sản xuất can xi oxit là đá vôi (chứa Ca
CO3). Chất đốt là than đá, củi, dầu, khí tự nhiên,…
Các phản ứng hóa học xẩy ra khi nung đá vôi
II. Lưu huỳnh đioxit
- công thức hóa học là SO2, tên thường gọi khác là khí sunfurơ.
1. đặc thù vật lí
Lưu huỳnh đioxit là hóa học khí ko màu, mùi hắc, độc (gây ho, viêm đường hô hấp…), nặng hơn không khí.
2. đặc điểm hóa học
Lưu huỳnh đioxit có tương đối đầy đủ tính chất hóa học của oxit axit.
a) tác dụng với nước tạo ra thành dung dịch axit:
SO2 + H2O → H2SO3 (axit sunfurơ)
SO2 là hóa học gây độc hại không khí, là 1 trong những trong các tại sao gây ra mưa axit.
b) tác dụng với dung dịch bazơ chế tạo thành muối với nước:
Ví dụ:
SO2 + Ca(OH)2 → Ca
SO3 ↓ + H2O
Khi SO2 dư sẽ liên tiếp có làm phản ứng sau:
SO2 (dư) + H2O + Ca
SO3 ↓ → Ca(HSO3)2
Như vậy khi đến SO2 chức năng với hỗn hợp bazơ tùy theo tỉ lệ về số mol mà sản phẩm thu được là muối bột trung hòa, muối axit hoặc tất cả hổn hợp cả hai muối.
3. Ứng dụng của diêm sinh đioxit
- phần lớn SO2 dùng để làm sản xuất axit sunfuric H2SO4.
- sử dụng làm chất tẩy trắng bột mộc trong sản xuất giấy, đường,…
- dùng làm hóa học diệt mộc nhĩ mốc,…
4. Điều chế lưu huỳnh đioxit
a) Trong phòng thí nghiệm: cho muối sunfit tính năng với axit dũng mạnh như HCl, H2SO4,…
Thí dụ:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
Khí SO2 được thu bằng cách thức đẩy ko khí.
b) trong công nghiệp: Đốt sulfur hoặc quặng pirit fe Fe
S2 trong không khí:
S + O2 → SO2
4Fe
S2 + 11O2 → 2Fe2O3 + 8SO2
Giải bài xích tập Hóa 9 bài xích 2 trang 9
Câu 1
Bằng phương thức hóa học nào rất có thể nhận hiểu rằng từng chất trong những dãy chất sau:
a) Hai chất rắn white color là Ca
O cùng Na2O.
b) Hai chất khí ko màu là CO2 với O2
Viết số đông phương trình bội nghịch ứng hóa học.
Gợi ý đáp án
a) lấy một không nhiều mỗi hóa học cho tính năng với nước, tiếp đến đem lọc, nước lọc của các dung dịch này được thử bằng khí CO2 hoặc hỗn hợp Na2CO3. Nếu có kết tủa white thì chất ban sơ là Ca
O, nếu không có kết tủa thì chất ban sơ là Na2O. Phương trình phản bội ứng :
Ca
O + H2O → Ca(OH)2
Ca(OH)2 + CO2 → Ca
CO3 ↓ + H2O
Hoặc Ca(OH)2 + Na2CO3 → Ca
CO3 ↓ + 2Na
OH
Na2O + H2O → 2Na
OH
2Na
OH + CO2 → Na2CO3 + H2O.
b) Sục hai hóa học khí không màu vào nhì ống nghiệm chứa nước vôi Ca(OH)2 trong. Ống nghiệm làm sao bị vẩn đục, thì khí lúc đầu là CO2, khí sót lại là O2.
PTPỨ: Ca(OH)2 + CO2 → Ca
CO3↓ + H2O
Câu 2
Hãy nhận thấy từng cặp chất trong mỗi nhóm chất sau bằng phương pháp hóa học:
a) Ca
O, Ca
CO3
b) Ca
O, Mg
O
Viết các phương trình bội nghịch ứng hóa học.
Gợi ý đáp án
Nhận biết từng chất trong mỗi nhóm chất sau:
a) Ca
O cùng Ca
CO3.
Lẫy mẫu thử từng hóa học cho từng mẫu mã thử vào nước khuấy đều.
Mẫu nào tác dụng mạnh cùng với H2O là Ca
O.
Mẫu sót lại không tung trong nước là Ca
CO3.
PTPỨ: Ca
O + H2O → Ca(OH)2
b) Ca
O cùng Mg
O.
Lấy chủng loại thử từng chất và cho tác dụng với H2O khuấy đều.
Mẫu nào làm phản ứng táo tợn với H2O là Ca
O.
Mẫu còn lại không chức năng với H2O là Mg
O.
PTPỨ: Ca
O + H2O → Ca(OH)2
Câu 3
200ml hỗn hợp HCl tất cả nồng độ 3,5mol/lit hòa tan toàn vẹn 20g tất cả hổn hợp Cu
O cùng Fe2O3.
a) Viết các phương trình làm phản ứng hóa học.
b) Tính cân nặng của từng oxit bazơ bao gồm trong các thành phần hỗn hợp ban đầu.
Gợi ý đáp án
VHCl = 200ml = 0,2 lít
n
HCl = 3,5 x 0,2 = 0,7 mol.
Gọi x, y là số mol của Cu
O và Fe2O3.
VHCl = 200ml = 0,02 lít
n
HCl = 3,5 x 0,02 = 0,7 mol.
Gọi x, y là số mol của Cu
O và Fe2O3
a)
Cu
O + 2HCl → Cu
Cl2 + H2O
x 2x
Fe2O3 + 6HCl → 2Fe
Cl3 + 3 H2O
y 6y
b)
⇒ n
HCl = 2x + 6y = 0,7 mol (∗)
mhỗn hợp = m
CuO + m
Fe2O3 = 80x + 160y = 20g
⇒ x + 2y = 0,25 ⇒ x = 0,25 – 2y (∗∗)
=> x = 0,25 - 2.0,1 = 0,05 mol
⇒ m
CuO = 0,05 x 80 = 4g
m
Fe2O3 = 0,1 x 160 = 16g
Câu 4
Biết 2,24 lit khí CO2 (đktc) công dụng vừa đủ với 200ml dung dịch Ba(OH)2 sản phẩm sinh ra là Ba
CO3 với H2O.
a) Viết phương trình bội phản ứng.
b) Tính mật độ mol của hỗn hợp Ba(OH)2 đã dùng.
c) Tính khối lượng chất kết tủa thu được.
Gợi ý đáp án
n
CO2 = V / 22,4 = 2,24 / 22,4 =0,1 mol.
CO2 + Ba(OH)2 → Ba
CO3 ↓ + H2O
n
Ba(OH)2 = n
CO2 = 0,1 mol,
VBa(OH)2 = 200ml = 0,2 lít
⇒ centimet Ba(OH)2 = n / V = 0,1 / 0,2 = 0,5 M.
c)n
BaCO3 = n
CO2 = 0,1 mol.
=> m
BaCO3 = 0,1 x 197 = 19,7 g.
Giải bài tập Hóa 9 bài 2 trang 11
Câu 1
Viết phương trình hóa học mang đến mỗi biến hóa sau:
Gợi ý đáp án
(1) S + O2

(2) SO2 + Ca
O → Ca
SO3
Hay SO2 + Ca(OH)2(dd) → Ca
SO3↓ + H2O
(3) SO2 + H2O ⇆ H2SO3
(4) H2SO3 + 2Na
OH → Na2SO3 + 2H2O
Hoặc H2SO3 + Na2O → Na2SO3 + H2O
(5) Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
Không buộc phải dùng phản bội ứng:
Na2SO3 + 2HCl → 2Na
Cl + SO2 ↑ + H2O vì HCl dễ bay hơi bắt buộc khí SO2 thu được sẽ không còn tinh khiết.
(6) SO2 + 2Na
OH → Na2SO3 + H2O
Hoặc SO2 + Na2O → Na2SO3
Câu 2
Hãy nhận thấy từng chất trong những nhóm chất sau bằng phương pháp hóa học:
a) Hai hóa học rắn màu trắng là Ca
O cùng P2O5.
b) Hai chất khí ko màu là SO2 và O2.
Viết các phương trình hóa học.
Gợi ý đáp án
Nhận biết các chất sau:
a) Ca
O với P2O5
Lẫy mẫu từng chất và cho vô nước thu được 2 dung dịch Ca(OH)2 cùng H3PO4
Dùng quỳ tím đến vào những mẫu này.
Mẫu nào làm cho quỳ tím hóa xanh là Ca(OH)2 → hóa học rắn ban sơ là: Ca
O.
Mẫu nào làm cho quỳ tím hóa đỏ là H3PO4 ⇒ hóa học rắn thuở đầu là P2O5
PTHH: Ca
O + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
b) SO2 với O2.
Lấy mẫu mã thử từng khí.
Lấy quỳ tím ẩm cho vào từng mẫu mã thử. Chủng loại nào làm quỳ tím hóa đỏ là SO2, còn lại là O2.
PTHH: SO2 + H2O → H2SO3
Câu 3
Có hầu như khí độ ẩm (khí tất cả lẫn hơi nước): cacbon đioxit, hiđro, oxi, lưu huỳnh đioxit. Khí nào rất có thể làm khô bằng canxi oxit? Giải thích.
Gợi ý đáp án
Điều kiện chất có thể làm thô được những chất khác:
+ phải hút ẩm được.
+ Không tác dụng với chất được gia công khô.
Ta thấy Ca
O bao gồm tính hút độ ẩm (hơi nước) sản xuất thành Ca(OH)2, đồng thời là 1 trong oxit bazơ (tác dụng cùng với oxit axit). Cho nên vì vậy Ca
O chỉ sử dụng làm khô những khí ẩm là hiđro ẩm, oxi ẩm.
Câu 4
Có phần lớn chất khí sau: CO2, H2, O2, SO2, N2. Hãy cho thấy thêm chất làm sao có tính chất sau:
a) Nặng hơn không khí.
b) nhẹ nhàng hơn khống khí.
c) Cháy được trong ko khí.
d) chức năng với nước tạo thành dung dịch axit.
e) làm đục nước vôi trong.
g) Đổi color giấy quỳ tím độ ẩm thành đỏ.
Gợi ý đáp án
a) những khí nặng rộng không khí: CO2, O2, SO2.
Vì Mkk = 29 g/mol.
MCO2 = 12 + 16.2 = 44 g/mol

⇒ CO2 nặng rộng kk
Tương tự: MO2 = 16.2 = 32 g/mol , MSO2 = 32 + 16.2 = 64g/mol
b) đầy đủ khí nhẹ hơn không khí: H2, N2.
Mkk = 29 g/mol.
MH2 = 1.2 = 2 g/mol

Tương tự: MN2 = 14.2 = 28g/mol
c) gần như khí cháy được trong không khí: H2.
2H2 + O2 → 2H2O
d) đông đảo khí công dụng với nước tạo thành thành dung dịch axit: CO2, SO2.
PTHH: CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
e) đầy đủ khí có tác dụng đục nước vôi trong: CO2, SO2.
Ca(OH)2 + CO2 → Ca
CO3 ↓ + H2O
Ca(OH)2 + SO2 → Ca
SO3 ↓ + H2O
g) phần đông khí làm thay đổi màu quỳ tím ẩm thành đỏ: CO2, SO2.
Quỳ tím ẩm ⇒ xẩy ra phản ứng cùng với nước chế tác axit có tác dụng quỳ tím chuyển đỏ
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
Câu 5
Khí diêm sinh đioxit được chế tạo ra thành trường đoản cú cặp hóa học nào sau đây:
a) K2SO3 và H2SO4.
b) K2SO4 cùng HCl.
c) Na2SO3 và Na
OH.
d) Na2SO4 và Cu
Cl2.
e) Na2SO3 và Na
Cl.
Gợi ý đáp án
Khí SO2 được sản xuất thành từ cặp chất: a
Phương trình hóa học minh họa:
K2SO3 + H2SO4 → K2SO4 + SO2 ↑ + H2O.
Câu 6
Dẫn 112ml khí SO2 (đktc) trải qua 700ml hỗn hợp Ca(OH)2 bao gồm nồng độ 0,01 M, thành phầm là muối canxi sunfit.
a) Viết phương trình phản bội ứng hóa học.
b) Tính khối lượng các chất sau bội nghịch ứng.
Xem thêm: Bộ Ảnh Khỏa Thân Nữ 100 % Đỏ Mặt Người Xem Ảnh Hỏa Thân, Ảnh Người Mẫu Khỏa Thân Lộ 100% Xem Là Phê
Gợi ý đáp án
a) SO2+ Ca(OH)2→ Ca
SO3↓ + H2O
1 mol 1 mol 1 mol 1 mol
b) VSO2= 112ml = 0,112 l; VCa(OH)2= 700ml = 0,7 l
n
SO2 = V / 22,4 = 0,112 / 22,4 = 0,005 (mol)
n
Ca(OH)2 = cm . V = 0,01. 0,7 = 0,007 (mol)
SO2 không còn Ca(OH)2 dư
Theo pt n
Ca(OH)2 = n
SO2 = 0,005 mol
⇒ n
Ca(OH)2 dư = 0,007 – 0,005 = 0,002 (mol)
m
Ca(OH)2 dư = n . M = 0,002 × 74 = 0,148 (g)
n Ca
SO3 = n
SO2 = 0,005 mol → m
CaSO3 = n. M = 0,005 × 120 = 0,6 (g).
Trắc nghiệm hóa học 9 bài xích 2
Câu 1: Ca
O nhằm lâu trong không khí bị giảm quality là vì:
A. Ca
O tính năng với O2
B. Ca
O chức năng với CO2
C. Ca
O dụng cùng với nước
D. Cả B cùng C
Câu 2: Ca
O cần sử dụng làm chất khử chua khu đất trồng là ứng dụng đặc thù hóa học gì của Ca
O?
A. Chức năng với axit
B. Tác dụng với bazơ
C. Công dụng với oxit axit
D. Tính năng với muối
Câu 3: áp dụng chất thử nào để phân minh hai chất rắn màu trắng: Ca
O cùng P2O5
A. Hỗn hợp phenolphtalein
B. Giấy quỳ ẩm
C. Hỗn hợp axit clohiđric
D. A, B cùng C phần nhiều đúng
Câu 4: Oxit được sử dụng làm hóa học hút độ ẩm (chất có tác dụng khô) trong phòng phân tích là:
A. Cu
O
B. Zn
O
C. Pb
O
D. Ca
O
Câu 5: Dẫn các thành phần hỗn hợp khí bao gồm CO2, CO, SO2lội qua dung dịch nước vôi vào (dư), khí thoát ra là:
A. CO
B. CO2
C. SO2
D. CO2 và SO2
Câu 6: Để phân biệt 3 khí ko màu: SO2, O2, H2đựng vào 3 lọ mất nhãn ta dùng