Tổng hợp kiến thức cần thế vững, các dạng bài tập và thắc mắc có kĩ năng xuất hiện nay trong đề thi HK2 môn hoá học sắp tới tới
CHƯƠNG IV: OXI – KHÔNG KHÍ
I/ TÍNH CHẤT CỦA OXI:
1/ đặc thù vật lý: Oxi là hóa học khí, ko màu, ko mùi, ít tan vào nước, nặng rộng không khí. Oxi hóa lỏng ở -183 0C . Oxi lỏng có màu xanh lá cây nhạt.
Bạn đang xem: Các dạng bài tập hóa lớp 8 học kì 2
2/ đặc điểm hóa học: Khí oxi là 1 trong những đơn chất phi kim hết sức hoạt động, quan trọng ở ánh sáng cao, dễ dàng tham gia bội phản ứng hóa học với rất nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nhân tố oxi bao gồm hóa trị II.
VD: S + O2 → SO2; 3Fe + 2O2 → Fe3O4
II/ SỰ OXI HÓA – PHẢN ỨNG HOÁ HỢP - ỨNG DỤNG CỦA OXI:
- Sự chức năng của oxi với cùng một chất là việc oxi hóa
- phản ứng hoá hòa hợp là phản nghịch ứng hóa học trong những số đó chỉ có 1 chất bắt đầu (sản phẩm) được tạo nên thành từ nhì hay những chất ban đầu.
VD: Ca
O+H2O → Ca(OH)2
- Ứng dụng của oxi: Khí oxi cần cho sự hô hấp của người và đụng vật, phải để đốt nhiên liệu trong đời sống và sản xuất.
III/ OXIT:
1.Định nghĩa oxit: Oxit là hợp hóa học của 2 nguyên tố, vào đó có một nguyên tố là oxi
Vd: K2O, Fe2O3, SO3, CO2….
2.Công thức dạng phổ biến của oxit Mx
Oy
- M: kí hiệu một nguyên tố không giống (có hóa trị n)
- công thức Mx
Oy theo đúng quy tắc về hóa trị.
=> n.x = II.y
3. Phân loại: bao gồm 2 nhiều loại chính: oxit axit với oxit bazơ
Vd:Oxit axit: CO2, SO3, P2O5…
. Oxit bazơ: K2O,Ca
O, Zn
O…
(*) cách gọi tên oxit :
a. Oxit bazơ:
Tên oxit = thương hiệu kim loại(kèm theo hóa trị) + oxit.
VD: Cu
O: đồng (II) oxit
b. Oxit axit
Tên oxit = tên phi kim (kèm tiền tố chỉ số nguyên tử phi kim) + oxit (kèm chi phí tố chỉ số nguyên tử oxi)
VD: : Đinito pentaoxit: N2O5
IV/ ĐIỀU CHẾ OXI – PHẢN ỨNG PHÂN HỦY:
1/ Điều chế khí oxi trong chống thí nghiệm: - nhiệt phân số đông chất nhiều oxi với dễ bị phân diệt ra oxi (KMn - phương pháp thu: Đẩy nước hoặc đẩy ko khí |
2KCl
O3 (xrightarrowt^o)2KCl+3O2
2/ chế tạo khí oxi trong công nghiệp: cần sử dụng nước hoặc không khí.
- bí quyết điều chế:
+ Hoá lỏng không gian ở nhiệt độ thấp cùng áp suất cao, kế tiếp cho không khí lỏng bay hơi đang thu được khí nitơ ngơi nghỉ -1960C tiếp nối là khí oxi nghỉ ngơi -1830C
+ Điện phân nước- (2H_2Oxrightarrowdp2H_2+O_2)
V/ KHÔNG KHÍ – SỰ CHÁY:
1.Thành phần của không khí: không khí là tất cả hổn hợp nhiều hóa học khí. Yếu tắc theo thể tích của không
khí là: 78 % khí nitơ, 21% khí oxi, 1% các chất khí không giống ( khí cacbonic, hơi nước, khí hiếm…)
2. Sự cháy: là việc oxi hóa tất cả tỏa nhiệt cùng phát sáng
3. Sự oxi hoá chậm: là việc oxi hóa tất cả tỏa nhiệt mà lại không vạc sáng
CHƯƠNG V: HIĐRO – NƯỚC
I/ TÍNH CHẤT CỦA HIĐRO :
1/ tính chất vật lý: Hiđro là chất khí, không màu, ko mùi, tan hết sức ít trong nước, vơi nhất trong các khí
2/ đặc điểm hóa học: Khí hiđro bao gồm tính khử, ở ánh sáng thích hợp, hiđro ko những phối hợp được với đối kháng chất oxi, cơ mà nó còn có thể kết phù hợp với nguyên tố oxi trong 1 số oxit kim loại. Những phản ứng này các tỏa những nhiệt.
2H2 +O2(xrightarrowt^0)2H2O
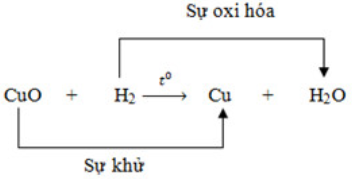
H2(k) +Cu
O(r) (xrightarrowt^0)Cu(r) +H2O(h)
II/ PHẢN ỨNG OXI HÓA KHỬ:
- Sự khử là sự tách bóc oxi thoát ra khỏi hợp chất.
- Sự lão hóa là sự công dụng của oxi với cùng một chất
- hóa học chiếm oxi của chất khác là hóa học khử. Chất nhường oxi cho chất khác là hóa học oxi hóa.
- phản bội ứng oxi hóa – khử là bội phản ứng hoá học trong các số ấy xảy ra bên cạnh đó sự oxi hóa và sự khử.
III/ ĐIỀU CHẾ KHÍ HIĐRO – PHẢN ỨNG THẾ:
1/ Trong chống thí nghiệm:Khí H2 được điều chế bằng cách cho axit ( HCl hoặc H2SO4 loãng) chức năng với sắt kẽm kim loại kẽm (hoặc sắt, nhôm)
PTHH: Zn+2HCl → H2 +Zn
Cl2
- Thu khí H2 bằng cách đẩy nước xuất xắc đầy ko khí.
- nhận ra khí H2 bằng que đóm đã cháy, H2 cháy với ngọn lửa color xanh
2/ trong công nghiệp:
- Điện phân nước:
(2H_2Oxrightarrowdp2H_2+O_2)
- Khử oxi của nước trong khí than
H2O+ C (xrightarrowt^o) CO+H2
3/Phản ứng thế: Là phản nghịch ứng hóa học giữa 1-1 chất với hợp chất, trong những số đó nguyên tử của đối chọi chất thay
thế nguyên tử của một nguyên tố không giống trong phù hợp chất
VD: fe + H2SO4 → Fe
SO4+ H2
IV/ NƯỚC:
1/ Thành phần hóa học của nước:
Nước là hợp hóa học tạo vì 2 yếu tố là hiđro với oxi.
+ Theo tỉ trọng về thể tích là 2 phần hiđro và một phần oxi
+ Theo tỉ lệ thành phần về trọng lượng là một trong những phần hiđro với 8 phần oxi
2/ đặc điểm của nước:
a/ đặc thù vật lý: Nước là hóa học lỏng, ko màu, ko mùi, không vị, sôi ngơi nghỉ 1000C, hóa rắn nghỉ ngơi 00C, d=1g/ml, hòa tan được rất nhiều chất rắn, lỏng, khí
b/ tính chất hóa học:
* tính năng với kim loại: Nước công dụng với một số ít kim loại ở ánh sáng thường ( như Na, K, Ca,…) tạo thành bazơ với hiđro.
2Na + 2H2O→2Na
OH + H2
* chức năng với 1 số ít oxit bazơ
- Nước tính năng với 1 số ít oxit bazơ chế tác thành bazơ. Dung dịch bazơ làm chuyển màu quì tím thành xanh.
VD: Ca
O + H2O→Ca(OH)2
*/ tác dụng với một số ít oxit axit:
- Nước công dụng với 1 số oxit axit tạo ra thành axit. Hỗn hợp axit làm thay đổi màu quì tím thành đỏ.
VD: P2O5 + 3H2O→2H3PO4
V/ AXIT – BAZƠ – MUỐI:
1/ AXIT:
1/ Định nghĩa: Axit là hợp hóa học mà phân tử gồm 1 hay các nguyên tử hiđro link với gốc axit
2/ Phân loại và gọi tên:
a/ Axit không có oxi: HCl, HBr, HF…
Tên axit = Axit + tên phi kim + hiđric
VD: HCl: axit clohiđric
b/ Axit tất cả oxi: H2SO4, HNO3, H3PO4, H2CO3…..
** Axit có khá nhiều nguyên tử oxi:
Tên axit = Axit + tên phi kim + ic
VD:H2SO4: axit sunfuric
** Axit bao gồm ít nguyên tử oxi:
Tên axit = Axit + thương hiệu phi kim + ơ
VD: H2SO3: axit sunfurơ
2/ BAZƠ:
1/ Định nghĩa: Bazơ là hợp chất mà phân tử gồm một nguyên tử kim loại liên kết với một hay những nhóm hiđroxit (- OH)
2/ Phân nhiều loại và hotline tên:
- phụ thuộc vào tính tung trong nước, bazơ chia thành 2 loại:
+ Bazơ tan điện thoại tư vấn là kiềm ( Vd: Na
OH, KOH, ,…..)
+ Bazơ không tan (Vd: Cu(OH)2, Mg(OH)2, Al(OH)3,…..)
- thương hiệu bazơ = tên sắt kẽm kim loại (kèm hóa trị ví như kim loại có khá nhiều hóa trị) + hiđrôxit.
VD: Na
OH : natri hiđroxit
3/ MUỐI
1/ Định nghĩa: muối hạt là hợp hóa học mà phân tử gồm gồm nguyên tử kim loại links với nơi bắt đầu axit
2/ Phân các loại và gọi tên:
- phụ thuộc vào thành phần phân tử, muối chia thành 2 loại:
+ muối bột trung hòa: là muối nhưng trong nơi bắt đầu axit không có nguyên tử hiđro (Vd: Na
Cl,Ca
CO3,…)
+ muối hạt axit: là muối nhưng mà trong gốc axit còn tồn tại nguyên tử hiđro (Vd:Na
H2PO4, Na2HPO4,…)
- Tên muối hạt = tên sắt kẽm kim loại (kèm hóa trị nếu kim loại nhiều hóa trị) + tên nơi bắt đầu axit
VD: Al2(SO4)3: nhôm sunfat
I/ DUNG DỊCH:
- hỗn hợp là láo lếu hợp nhất quán của dung môi và hóa học tan
- Ở nhiệt độ xác định:
+ Dung dịch chưa bão hòa là dung dịch hoàn toàn có thể hòa tan thêm chất tan
+ dung dịch bão hòa là dung dịch bắt buộc hòa rã thêm chất tan
- mong mỏi chất rắn tan nhanh trong nước, ta triển khai 1, 2 hoặc cả 3 biện pháp sau:khuấy dung dịch, đun cho nóng dung dịch, nghiền nhỏ tuổi chất rắn.
II/ ĐỘ chảy CỦA MỘT CHẤT vào NƯỚC:
- Độ tan (S) của 1 chất là số gam chất đó chảy được vào 100g nước để sản xuất thành dung dịch bão hòa tại 1 nhiệt độ xác định.
- Độ tung của chất rắn sẽ tăng giả dụ tăng sức nóng độ. Độ tan của hóa học khí đang tăng nếu giảm nhiệt độ với tăng áp suất
Để chuẩn bị cho kì thi học kì 2 lớp 8 sắp đến tới, Vn
Doc nhờ cất hộ tới chúng ta Đề cương ôn tập học tập kì 2 môn chất hóa học lớp 8 năm 2022 - 2023 có đáp án cho chúng ta tham khảo, lên kế hoạch ôn tập phù hợp để sẵn sàng cho kì thi chất hóa học 8 sắp tới đạt công dụng cao.
Nội dung đề cương gửi ra bám đít nội dung công tác học. Giúp các bạn tổng vừa lòng lại con kiến thức, ôn tập để chuẩn bị cho bài bác thi môn Hóa 8 học tập kì 2. Đồng thời đây cũng là 1 kho tài liệu vô cùng có ích với thầy cô xem thêm trước lúc ra đề thi.
A. Đề cương cứng ôn tập học kì II môn hóa học lớp 8
Bản quyền thuộc về Vn
Doc nghiêm cấm rất nhiều hành vi xào luộc vì mục đích thương mại
PHẦN 1. TÓM TẮT KIẾN THỨC CƠ BẢN
A. CHƯƠNG 4: OXI-KHÔNG KHÍ
I. TÍNH CHẤT CỦA OXI
1. đặc điểm vật lí
Là chất khí, ko màu, không mùi, ít tan vào nước, nặng hơn không khí. Lão hóa lỏng ở nhiệt độ -183o
C, oxi ngơi nghỉ thể lỏng có màu xanh lá cây nhạt.
2. Tính chất hóa học
Oxi là một trong đơn chất phi kim chuyển động mạnh, nhất là ở nhiệt độ cao, dễ dãi tham gia bội nghịch ứng hóa học với khá nhiều phi kim, nhiều kim loại và đúng theo chất.
a. Chức năng với phi kim (S, N, P…)
S + O2

b. Tính năng với kim loại
Oxi bao gồm thể tác dụng với hầu hết các sắt kẽm kim loại dưới tính năng của ánh nắng mặt trời để tạo nên các oxit (trừ một vài kim nhiều loại Au, Ag, Pt oxi ko phản ứng
2Mg + O2

O
2Zn + O2

O
c. Công dụng với đúng theo chất
2H2S + 3O2

II. SỰ OXI HÓA - PHẢN ỨNG HÓA HỢP - ỨNG DỤNG CỦA OXI1. Sự oxi hóa
Là sự công dụng của oxi với 1 chất
2. Làm phản ứng hóa hợp
Phản ứng hóa đúng theo là phản ứng hóa học trong số ấy chỉ bao gồm một chất bắt đầu được chế tạo ra thành từ nhì hay nhiều chất ban đầu.
Phản ứng buộc phải nâng ánh nắng mặt trời lên để khơi mào làm phản ứng lúc đầu, các chất vẫn cháy, tỏa những nhiệt điện thoại tư vấn là bội phản ứng lan nhiệt.
III. OXIT
1. Định nghĩa
Oxit là hợp chất của ha yếu tắc , trong các số ấy có một nguyên tố là oxi
2. Phân loại
a. Oxit axit
Thường là oxit của phi kim và khớp ứng với một axit
Ví dụ: SO3 khớp ứng với axit H2SO4
b. Oxit bazơ
Thường là oxit của kim loại và tương ứng với một bazơ
Na
O khớp ứng với Na
OH
3. Giải pháp gọi tên
Tên oxit = tên yếu tắc + oxit
Nếu kim loại có không ít hóa trị
Tên oxit = tên kim loại (hóa trị) + oxit
Ví dụ: Fe
O: fe (II) oxit
Nếu phi kim có nhiều hóa trị
Tên gọi = tên phi kim + oxit
Dùng các tiền tố ( tiếp đầu ngữ) chỉ số nguyên tử
+ Mono: một + Đi: hai
+ Tri: ba + Tetra: tứ + Penta: năm
Ví dụ: CO: cacbon monooxit
IV. Điều chế khí oxi - phản ứng phân hủy
1. Điều chế oxi
a. Trong chống thí nghiệm
Đun rét hợp chất giâu oxi với dễ bị phân diệt ở ánh sáng cao như kali pemanganat KMn
O4 hoặc kali clorat KCl
O3 vào ống nghiệm, oxi bay ra theo
2KMn
O4

O4 + Mn
O2 + O2
2KCl
O3

b. Vào công nghiệp
Sản xuất từ ko khí: hóa lỏng không khí ở ánh nắng mặt trời thấp với áp suất cao. đầu tiên thu được Nitơ (-196°C) kế tiếp là Oxi (- 183°C)Sản xuất từ nước: điện phân nước2. Phản nghịch ứng phân hủy
Là phản ứng hóa học trong các số ấy từ môtj chất sinh ra nhiều chất mới.
Ví dụ: 2KMn
O4

O4 + Mn
O2 + O2
V. KHÔNG KHÍ - SỰ CHÁY
1. Không khí
Không khí là một hỗn thích hợp khí trong số ấy oxi chiếm phần khoảng 01/05 thể tích. Cự thể oxi chiếm 21% thể tích, 78% nitơ, 1% là các khí khác
2. Sự cháy và sự thoái hóa chậm
Sự cháy là việc oxi hóa tất cả tỏa nhiệt cùng phát sáng
Sự oxi hóa chậm là sự oxi hóa gồm tỏa nhiệt dẫu vậy không phát sáng
Trong điều kiện nhất định, sựu thoái hóa chậm rất có thể chuyển thành sự cháy
B. CHƯƠNG 5: HIDRO - NƯỚC
I. Tính chất - Ứng dụng của Hiđro1. đặc điểm vật lý
Là chất khí ko màu, không mùi, không vị, vơi nhất trong những khí, tan rất ít vào nước
2. đặc thù hóa học
a. Công dụng với oxi
2H2 + O2

Hỗn hợp sẽ gây nên nổ trường hợp trộng hidrơ với oxi theo tỉ trọng thể tích 2:1
b. Công dụng với đồng oxit Cu
O
Bột Cu
O màu đen chuyển thành lớp kim loại đồng màu đỏ gạch và gồm có giọt nước tạo thành bên trên thành cốc
H2 + Cu
O

II. Điều chế khí Hiđrơ - phản nghịch ứng thế1. Điều chế hidrơ
a. Trong chống thí nghiệm
Cho kim loại (Al, Fe,….) công dụng với hỗn hợp axit (HCl, H2SO4)
Ví dụ: sắt + 2HCl → Fe
Cl2 + H2
b. Vào công nghiệp
Hidro được điều chế bằng cách điện phân nước hoặc sử dụng than khử oxi của H2O
Phương trình hóa học
2H2O

2. Bội nghịch ứng thế
Phản ứng cụ là bội phản ứng chất hóa học của solo chất và hợp chất trong số đó nguyên tử của đối kháng chất thay thế nguyên tử của một nguyên tố không giống trong phù hợp chất
VD: fe + 2HCl → Fe
Cl2 + H2
III. Nước
1. đặc thù vật lý
Là hóa học lỏng không màu (tuy nhiên lớp nước dày có greed color da trời), không mùi, ko vị. Sôi ở 100°C (p = 760 mm
Hg), hóa rắn ngơi nghỉ 0°C.
Có thể hòa tan được rất nhiều chất rắn (muối ăn, đường,…), chất lỏng (cồn, axit), hóa học khí (HCl,…)
2. đặc thù hóa học
Tác dụng cùng với kim loại: nước gồm thể tính năng với một trong những kim các loại ở ánh nắng mặt trời thường như Ca, Ba, K,…
Phương trình hóa học
K + H2O → KOH + H2
Tác dụng với mốt số oxit bazo như Ca
O, K2O,… tạo thành bazơ khớp ứng Ca(OH)2, KOH,…
Dung dịch bazơ có tác dụng quỳ tím gửi xanh
VD: K2O + H2O → 2KOH
Dung dịch axit làm cho quỳ tím gửi đỏ
VD: SO3 + H2O → H2SO4
IV. Axit - Bazơ - Muối1. Axit
a. Khái niệm
Phân tử axit gồm gồm một hay nhiều nguyên tử hihdro liên kết với nơi bắt đầu axit, những nguyên tử hidro này có thể thay cố bằng các nguyên tử kim loại
b. CTHH: bao gồm một hay nhiều nguyên tử H và nơi bắt đầu axit
c. Phân loại: 2 loại
Axit không có oxi: HCl, H2S,…Axit gồm oxi: H2SO4, H2CO3,…d. Thương hiệu gọi
Axit không tồn tại oxi
Tên axit = axit + tên phi kim + hidric
VD: HCl: axit clohidric. Cội axit tương ứng là clorua
Axit tất cả oxi
Axit có không ít oxi:Tên axit = axit + thương hiệu phi kim + ic
VD: H2SO4 : axit sunfuric. Nơi bắt đầu axit: sunfat
Axit gồm ít oxi:Tên axit = axit + tên phi kim + ơ
VD: H2SO3 : axit sunfuro. Cội axit sunfit
2. Bazơ
a. Khai niệm
Phân tử bazơ gồm gồm môt nguyên tử kim loại links với một hay nhiều nhóm hidroxit (-OH).
b. CTHH: M(OH)n, n: số hóa trị của kim loại
c. Tên gọi
Tên bazơ = tên kim loại ( kèm hóa trị nếu có không ít hóa trị) + hiđroxit
VD: Fe(OH)2: fe (II) hidroxit
d. Phân loại
Bazơ chảy trong nước điện thoại tư vấn là kiềm. VD: Na
OH, KOH, Ca(OH)2, Ba(OH)2.
Bazơ ko tan vào nước. VD: Cu(OH)2, Fe(OH)2, Fe(OH)3,…
3. Muối
a. Khái niệm
Phân tử muối gồm một hay nhiều nguyên tử kim loại links với môht hay nhiều gốc axit
b. CTHH: bao gồm 2 phần: sắt kẽm kim loại và nơi bắt đầu axit
VD: Na2SO4, Ca
CO3,…
c. Tên gọi
Tên muối bột = tên sắt kẽm kim loại (kèm hóa trị nếu có rất nhiều hóa trị) + tên nơi bắt đầu axit
VD: Na2SO4 : natri sunfat
d. Phân loại
Muối trung hòa: là muối cơ mà trong cội axit không có nguyên tử hiđro rất có thể thay thay bằng các nguyên tử kim loạiVD: Na2SO4, Ca
CO3,…
Ví dụ: Na
HSO4, Na
HS, Na
HSO3,…
C. CHƯƠNG 6: DUNG DỊCH
I. Dung môi – chất tan – dung dịch
Dung môi là chất có tác dụng hòa tan chất khác để chế tạo ra thành dung dịch.
Chất tan là chất bị phối hợp trong dung môi.
Dung dịch là hỗn hợp đồng bộ của dung môi và hóa học tan.
II. Dung dịch không bão hòa. Dung dịch bão hòa
Ở một ánh nắng mặt trời xác định:
Dung dịch chưa bão hòa là dung dịch có thể hòa thêm hóa học tanDung dịch bão hòa là dung dịch chẳng thể hòa thêm hóa học tan
III. Độ tung của một hóa học trong nước
Độ chảy (kí hiệu S) của một hóa học trong nước là số gam chất đó hòa tan trong 100g nước để chế tác thành hỗn hợp bão hòa ở ánh nắng mặt trời xác định.
Công thức tính:

V. NỒNG ĐỘ DUNG DỊCH
1. Nồng độ phần trăm
Nồng độ tỷ lệ (kí hiệu C%) của một dung dịch mang đến ta biết số gam hóa học tan trong 100g dung dịch

2. độ đậm đặc mol dung dich
Nồng độ mol (kí hiệu CM) của dung dịch cho biết số mol chất tan trong một lit dung dịch

PHẦN 2. TRẮC NGHIỆM
Khoanh tròn vào một trong những chữ cái A, B, C hoặc D đứng trước cách thực hiện chọn đúng:
Câu 1. Oxit là:
A. Hợp chất của oxi với cùng 1 nguyên tố khác
B. đúng theo chất bao gồm 2 nguyên tố, vào đó có một nguyên tố là oxi.
C. Hợp hóa học được tạo vì chưng nguyên tố oxi với 1 nguyên tố nào đó.
D. Cả A, B, C đúng.
Câu 2. Oxit axit là:
A. Là oxit của phi kim cùng tương ứng với 1 axit
B. Là oxit của kim loại và tương ứng với một axit
C. Là oxit của phi kim cùng tương ứng với 1 oxit axit
D. Hay là oxit của phi kim cùng tương ứng với cùng 1 axit
Câu 3. Oxit bazơ là:
A. Là oxit của phi kim và kim loại, tương ứng với 1 bazơ
B. Là oxit của sắt kẽm kim loại và tương ứng với một bazơ
C. Thường là oxit của phi kim với tương ứng với một bazơ
D. Là oxit của phi kim và tương ứng với cùng một oxit axit
Câu 4. cho những oxit sau: SO2, SO3, Fe2O3, P2O5, K2O, NO, CO. Trong các số đó có mấy oxit axit
A. 4
B. 2
C. 3
D. 1
Câu 5. Cho các oxit sau: Ba
O, SO3, Fe
O, P2O5, Na2O. Trong đó có mấy oxit bazo
A. 1
B. 3
C. 2
D. 4
Câu 6. cho các oxit có công thức hóa học sau:
CO2; NO; Ba
O; P2O5 ; NO2; K2O; Zn
O; N2O5 ; Al2O3
a) những oxit axit được sắp xếp như sau:
A. CO2; NO; NO2; K2O
B. NO; Ba
O; P2O5; N2O5
C. CO2 ; P2O5 ; NO2 ; N2O5
D. Ba
O; P2O5; K2O; Al2O3
b) các oxit bazơ được thu xếp như sau:
A. Ba
O ; K2O; Zn
O ; N2O5
B. Ba
O ; Zn
O ; K2O ; Al2O3
C. Ba
O; P2O5; K2O; Al2O3
D. Zn
O; N2O5; K2O; Al2O3
Câu 7. trong các oxít sau đây, oxít nào tính năng được với nước
A. SO3, Cu
O, K2O
B. SO3 , K2O, CO2, Ba
O
C. SO3, Al2O3, K2O
D. N2O5, K2O, Zn
O
Câu 8. giữa những chất sau đây, hóa học nào là axít
A. H2Si
O3, H2SO4, Cu(OH)2, K2Si
O3
B. HNO3, Al2O3, Na
HSO4, Ca(OH)2
C. H3PO4, HNO3, H2S
D. H2S, Al2O3, H2SO4, Ca(OH)2
Câu 9. Hợp chất nào dưới đây là các bazơ tung trong nước:
A. Mg(OH)2; Ba(OH)2; Al(OH)3
B. Na
OH; KOH ; Ca(OH)2
C. Na
OH; Cu(OH)2; Ag
OH
D. KOH; Zn(OH)2; Na
OH
Câu 10. dãy hợp hóa học gồm những bazơ rất nhiều không chảy trong nước:
A. Mg(OH)2; Cu(OH)2 ; Fe(OH)3
B. Na
OH ; KOH ; Ca(OH)2
C. Na
OH; Fe(OH)2; Li
OH
D. Al(OH)3; Zn(OH)2; Ca(OH)2.
Câu 11. Dung dịch làm quỳ tím hóa đỏ là:
A. H2O
B. Dung dịch Na
OH
C. Hỗn hợp H2SO4
D. Dung dịch K2SO4
Câu 12. Hoàn toàn có thể phân biệt những dung dịch axit, muối bột ăn, kiềm bằng phương pháp dùng:
A. Nước cất
B. Giấy quỳ tím
C. Giấy phenolphtalein
D. Khí CO2
Câu 13. gồm có chất rắn sau: Fe
O, P2O5, Ba(OH)2, Na
NO3. Thuốc demo được lựa chọn để phân biệt những chất bên trên là:
A. Dung dịch H2SO4, giấy quỳ tím.
B. H2O, giấy quỳ tím.
C. Dung dịch Na
OH, giấy quỳ tím.
D. Dung dịch HCl, giấy quỳ.
Câu 14. Dãy chất nào tiếp sau đây gồm toàn muối:
A. KCl, HNO3, Fe
Cl2, Na
HCO3
B. Na
NO3, Al2(SO4)3, Na
OH, H2SO4
C. Zn
Cl2, Mg(NO3)2, KCl, H2S
D. Mg(NO3)2, Zn
Cl2, Fe
Cl2, Ag
Cl.
Câu 15. cho biết thêm phát biểu như thế nào dưới đó là đúng:
A. Gốc cacbonat (CO3) và sunfat (SO4) hoá trị III
B. Cội photphat (PO4) hoá trị II
C. Gốc Clorua (Cl) cùng Nitrat (NO3) hoá trị I
D. Team hiđroxit (OH) hoá trị II
Câu 16. Từ cách làm hoá học tập Fe2O3 với H2SO4, phương pháp tạo bởi Fe với SO4 là:
A. Fe
SO4
B. Fe2(SO4)3
C. Fe(SO4)3
D. Fe3(SO4)2
Câu 17. cho những phương trình phản bội ứng sau:
1. Zn + 2HCl

Cl2 + H2
2. 2H2O

3. 2Al + 3H2SO4

4. 2Mg + O2

O
5. 2KCl
O3

6. H2 + Cu
O

7. 2H2 + O2

a. Làm phản ứng hoá đúng theo là:
A. 1, 3
B. 2, 5
C. 4,7
D. 3, 6
b. Phản nghịch ứng phân huỷ là:
A. 5, 6
B. 2 , 5
C. 4, 5
D. 2, 7
c. Phản bội ứng nắm là:
A. 1, 3, 6
B. 1, 3, 7
C. 3, 5, 6
D. 4, 6, 7.
Câu 18. Cặp hóa học nào sau đây dùng để làm điều chế oxi trong phòng thí nghiệm:
A. H2O, KCl
O3
B. KMn
O4, Ca
CO3
C. KCl
O3, KMn
O4
D. HCl, Mg
Câu 19. cho những khí: CO, N2, O2, Cl2, H2 .Các khí nhẹ nhàng hơn không khí là:
A. N2, H2, CO
B. N2, O2, Cl2
C. CO, Cl2
D. Cl2, O2
Câu 20. Ứng dụng của hiđro là:
A. Sử dụng làm vật liệu cho bộ động cơ xe lửa
B. Cần sử dụng làm chất khử nhằm điều chế một trong những kim một số loại từ oxit của chúng
C. Dùng để bơm vào khinh thường khí cầu
D. Dùng để khử trùng cạnh bên khuẩn
Câu 21. Trong phòng thí nghiệm người ta pha chế hidro bằng cách nào bên dưới đây:
A. Mang lại Zn tính năng với dd HCl
B. Điện phân nước
C. Cho K tính năng với nước
D. Cho Zn chức năng với dd H2SO4 sệt nóng
Câu 22. Sự oxi hóa là:
A. Sự công dụng của oxi với cùng 1 kim loại.
B. Sự tính năng của oxi với 1 phi kim.
C. Sự công dụng của oxi với cùng một chất.
D. Sự tác dụng của oxi với một nguyên tố hoá học.
Câu 23. Sự oxi hóa chậm trễ là:
A. Sự oxi hóa mà lại không lan nhiệt
B. Sự oxi hóa nhưng mà không vạc sáng
C. Sự thoái hóa toả nhiệt cơ mà không phân phát sáng
D. Sự tự bốc cháy
Câu 24. Nước là hợp hóa học mà phân tử được tạo nên bởi:
A. Một nguyên tử H và một nguyên tử O
B. Hai nguyên tử H và một nguyên tử O
C. Hai nguyên tử H cùng hai nguyên tử O
D. Một nguyên tử H cùng hai nguyên tử O.
Câu 25. Để tổng hòa hợp nước bạn ta đã đốt cháy hoàn toàn 2,24 lít khí hiđro ( đktc) vào oxi. Thể tích khí oxi nên dùng là:
A. 1,12 lit
B. 2,24 lit
C. 22,4 lit
D. 11,2 lit
Câu 26. đến H2O chức năng vừa đầy đủ với Na. Sản phẩm tạo ra là:
A. Na2O
B. Na
OH với H2
C. Na
OH
D. Không tồn tại phản ứng.
Câu 27. hỗn hợp là lếu láo hợp:
A. Của chất khí trong hóa học lỏng
B. Của chất rắn trong chất lỏng
C. Đồng độc nhất của hóa học lỏng và dung môi
D. Đồng tốt nhất của dung môi và hóa học tan.
Câu 28. lúc hoà tung 100ml rượu etylic vào 50ml nước thì:
A. Rượu là hóa học tan với nước là dung môi
B. Nước là chất tan với rượu là dung môi
C. Nước cùng rượu hồ hết là chất tan
D. Nước với rượu đa số là dung môi
Câu 29. Khi tăng nhiệt độ và giảm áp suất thì độ tung của hóa học khí vào nước biến hóa như rứa nào?
A. Tăng
B. Giảm
C. Hoàn toàn có thể tăng hoặc giảm
D. Không chũm đổi
Câu 30. trong thí nghiệm đến từ từ bỏ 2 muỗng đường vào nước. Dung dịch mặt đường này hoàn toàn có thể hòa tung thêm đường,
A. Dung dịch đường bão hòa
B. Hỗn hợp đường chưa bão hòa
C. Dung dịch đồng nhất
D. Cả A, B, C đa số đúng
Câu 31. Người ta thu khí oxi bằng cách đẩy không khí là nhờ phụ thuộc vào tính chất:
A. Khí oxi nhẹ hơn không khí
B. Khí oxi nặng hơn không khí
C. Khí oxi dễ xáo trộn với ko khí
D. Khí oxi không nhiều tan trong nước
Câu 32. Phản ứng làm sao dưới đấy là phản ứng thế:
A. 2KCl
O3 → 2KCl + O2
B. P2O5 + H2O → H3PO4
C. Fe
O + 2HCl → Fe
Cl2 + H2O
D. Cu
O + H2 → Cu + H2O
Câu 33. Có 4 lọ mất nhãn đựng 4 chất bột màu trắng gồm: Ba
O, K2O, Mg
O với P2O5. Dùng thuốc thử nào để nhận ra các chất trên?
A. Cần sử dụng nước với dung dịch H2SO4
B. Sử dụng dung dịch H2SO4 và phenolphtalein
C. Cần sử dụng nước cùng giấy quì tím
D. Không có chất làm sao thử được
Câu 34. Tại sao trong chống thí nghiệm tín đồ ta lại pha trộn oxi bằng cách nhiệt phân KCl
O3 xuất xắc KMn
O4 hoặc KNO3?
A. Dễ kiếm, giá thành rẻ
B. Nhiều oxi cùng dễ phân huỷ ra oxit
C. Tương xứng với thiết bị đồ đạc hiện đại
D. Ko độc hại, dễ dàng sử dụng
Câu 35. Để tính độ đậm đặc mol của hỗn hợp Na
OH bạn ta làm rứa nào?
A.Tính số gam Na
OH gồm trong 100 gam dung dịch.
B.Tính số gam Na
OH có trong một lít dung dịch.
C.Tính số gam Na
OH bao gồm trong 1000 gam dung dịch.
D.Tính số mol Na
OH có trong 1 lít dung dịch.
Câu 36. Hoà tan 20 gam muối bột vào nước được dung dịch tất cả nồng độ 10%
A. 200 gam.
B. 300 gam.
C. 400 gam.
D. 500 gam.
Câu 37. Tính cân nặng của Ba(OH)2 có trong 300 ml dung dịch Ba(OH)2 0,4M.
A. 27,36 gam
B. 2,052 gam
C. 20,52 gam
D. 9,474 gam
Câu 38. Với một lượng hóa học xác định, khi tăng thể tích dung môi thì:
A. Nồng độ tỷ lệ C% tăng, độ đậm đặc mol centimet tăng.
B. Nồng độ phần trăm C% giảm, độ đậm đặc mol centimet giảm.
C. Nồng độ xác suất C% tăng, nồng độ mol centimet giảm.
D. Nồng độ tỷ lệ C% giảm, nồng độ mol centimet tăng.
Câu 39. Câu nào dưới đây đúng khi nói tới nồng độ phần trăm? Nồng độ xác suất cho biết:
A. Số gam chất tan tất cả trong 100g dung dịch
B. Số gam chất tan bao gồm trong 100g dung dịch bão hòa.
C. Số gam hóa học tan bao gồm trong 100g nước
D. Số gam chất tan có trong 1 lít dung dịch.
Câu 40. dung dịch H2SO4 0,25M cho biết:
A. Trong 1 lít dung dịch tất cả hòa tung 0,25 mol H2SO4.
B. Trong một lít dung môi có hòa chảy 0,25 mol H2SO4.
C. Trong một lít nước gồm hòa chảy 0,25 mol H2SO4.
D. Trong 1 lít nước bao gồm hòa chảy 0,25 lít H2SO4.
PHẦN 3. TỰ LUẬN
1. kết thúc các phản ứng hóa học sau và cho thấy thêm phản ứng làm sao là: bội nghịch ứng hóa hợp, phản bội ứng cháy, phản bội ứng phân hủy, bội nghịch ứng thế
a/ ……….+………

O
b/ ………+ ………

c/ ………+ ………

d/ ………+ ………

e/ H2O

f/ KCl
O3

g/ ……… +………

Cl2
h/ KMn
O4

i/ Zn + HCl

j/ Al + H2SO4

k/ H2 + ………

l/ Ca
O + H2O

2. Nhiệt độ phân hoàn toàn 24,5g KCl
O3. Tính thể tích khí O2 (ở đktc) thu được?
3. mong muốn điều chế được 5,6 lít O2 (ở đktc) thì cân nặng KMn
O4 buộc phải nhiệt phân là bao nhiêu?
4. Trong chống thí nghiệm, bạn ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hóa sắt ở nhiệt độ cao. Để pha trộn được 2,32g Fe3O4 đề xuất dùng:
a) bao nhiêu gam sắt?
b) từng nào lít khí O2 (ở đktc)?
5. Đốt cháy hoàn toàn 2,7g nhôm. Tính :
a) Thể tích khí O2 (đktc) phải dùng?
b) Số gam KMn
O4 cần dùng để điều chế lượng khí O2 trên?
7. xác minh công thức hóa học của nhôm oxit, biết tỉ lệ trọng lượng của 2 yếu tắc nhôm cùng oxi bằng 9 : 8.
8. Một oxit của lưu lại huỳnh trong các số ấy oxi chiếm phần 60% về khối lượng. Tìm cách làm phân tử của oxit đó?
9. đến 11,2 g fe vào 200 ml dung dịch H2SO4 2M. Hãy:
a) Tính lượng khí H2 tạo nên ở đktc?
b) chất nào còn dư sau phản ứng với lượng dư là bao nhiêu?
c) Tính nồng độ những chất sau phản ứng?
10. cho 28,4g điphotpho pentaoxit P2O5 vào cốc đựng 90g nước để tạo thành thành axit photphoric. Tinh cân nặng axit H3PO4 được chế tác thành?
11. gọi tên, phân loại các chất sau: Ca(OH)2, Na
OH, KOH, Mg(OH)2, HNO3, H2SO4, HCl, H3PO4, Na
Cl, Fe
O, Cu
O, K2SO4, Na3PO4, Ag
NO3, Ca
SO4, Na
HCO3, Mg
O, Na
HSO4, Ca(HCO3)2, Na
H2PO4
12. Hãy phân biệt những chất sau :
a) 4 bình đựng riêng lẻ các khí sau: ko khí, khí oxi, khí hiđro, khí cacbonic
b) 3 lọ mất nhãn đựng dung dịch KOH, H2SO4, Mg
Cl
c) có 3 gói bột mất nhãn chứa các chất sau: Na2O, SO3, Ca
O
B. Đáp án phần trắc nghiệm đề cương ôn thi Hóa 8 kì 2
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | A | B | C | B | C,B | B | C | B | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | B | B | D | C | B | C,B,A | C | A | B |
| 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| A | D | B | A | B | D | B | D | B | A |
| 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| B | D | C | B | D | A | C | B | A | A |
C. Đáp án thắc mắc tự luận đề cưng cửng ôn thi học tập kì 2 hóa 8
Câu 1.
a/ 2Zn + O2

O
b/ 3H2O + P2O5 → 2H3PO4
c/ CH4 + 2O2 → CO2 + 2H2O
d/ 2K + S

e/ H2O

f/ 2KCl
O3

g/ Cu + Cl2 → Cu
Cl2
h/ 2KMn
O4

O4 + Mn
O2 + O2
i/ Zn + 2HCl → Zn
Cl2 + H2
j/ 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
k/ H2 + Cu
O

l/ Ca
O + 2H2O → Ca(OH)2 + H2
Câu 2.
n
KCl
O3 = 24,5/122,5 = 0,2 mol
Phương trình bội nghịch ứng
2KCl
O3

0,2 → 0,3 mol
VO2 = 0,3.22,4 = 6,72 lít
Câu 3.
n
O2 = 5,6/22,4 = 0,25 mol
Phương trình hóa học
2KMn
O4 → K2Mn
O4 + Mn
O2 + O2
0,5 ← 0,25 mol
m
KMn
O4 = 0,5. 158 = 79 gam
Câu 4.
n
Fe3O4 = 0,01 mol
Phương trình hóa học
3Fe + 2O2 → Fe3O4
0,03 ← 0,02 ← 0,01 mol
m
Fe = 0,03 .56 = 1,68 gam
VO2 = 0,02.22,4 = 0,448 lít
Câu 5.
Phương trình hóa học
4Al + 3O2 → 2Al2O3
0,1 → 0,075 mol
VO2 = 0,075.22,4 = 1,68 mol
2KMn
O4 → K2Mn
O4 + Mn
O2 + O2
0,15 ← 0,075 mol
m
KMn
O4 = 0,15. 158 = 23,7 gam
Câu 7.
Gọi CTHH của nhôm oxi là Alx
Oy
có :27x/16y = 9/8
x/y = 2/3
→ Al2O3
Câu 8.
Phần trăm về cân nặng của nguyên tố lưu hoàng trong oxit đó là:
%m
S = 100%− %m
O = 100% − 60% = 40%
Ta gọi phương pháp dạng tầm thường của oxit yêu cầu tìm là Sx
Oy (x,y: nguyên, dương)
Theo đề bài bác ta có:
x/y = 40/32 : 60/16 =1/3 => x = 1; y = 3
Vậy cách làm hóa học tập của oxit đề xuất tìm là SO3
Câu 9. Cho 11,2 g sắt vào 200 ml dung dịch H2SO4 2M. Hãy:
a) Tính lượng khí H2 tạo ra ở đktc?
b) chất nào còn dư sau bội phản ứng cùng lượng dư là bao nhiêu?
c) Tính nồng độ những chất sau phản bội ứng?
Số mol các chất đề bài bác cho là:
n
Fe =11,2/56 = 0,2mol
n
H2SO4 = CM.V = 2.0,2 = 0,4 mol
Phương trình hóa học
Fe + H2SO4 → Fe
SO4 + H2
Lập tỉ lệ:
n
Fe/1 2SO4/1 (0,2 2SO4 vẫn tồn tại dư, lượng những chất tính theo hóa học hết
n
H2 = n
Fe = 0,2 mol
VH2 = n. 22,4 =0,2. 22,4 = 4,48 lít
b) n
H2SO4 pứ = n
Fe = 0,2 mol
-> n
H2SO4 dư = n
H2SO4 ban sơ - n
H2SO4 pứ = 0,4 - 0,2 = 0,2 mol
m
H2SO4 = 0,2. 98 =19,6 gam
Câu 10.
Số mol các chất đề bài bác cho là:
n
P2O5 = 28,4/142 = 0,2 mol
n
H2O = 90/18 = 5 mol
P2O5 + 3H2O → 2H3PO4
So sánh tỉ lệ mol 2 chất
0,2/1 Sau phản bội ứng H2O dư, P2O5 bội phản ứng hết, lượng hóa học trong bài bác tính theo hóa học hết
Phương trình hóa học
P2O5 + 3H2O → 2H3PO4
=> n
H3PO4 = 0,2.2 = 0,4 mol
=> m
H3PO4 = 0,4.98 = 39,2g
Câu 12.
a) mang đến que đóm vẫn cháy vào cụ thể từng lọ nếu:
Que đóm cháy bình thường là ko khí
Que đóm cháy mạnh dạn hơn là oxi
Khí vào bình cháy với ngọn lửa màu xanh là hidro
Que đóm vụt tắt là khí cacbonic
b) mang lại mẩu giấy quỳ tím vào tía mẩu test nếu:
Mẩu giấy quỳ tím hóa xanh là Na
OH
Mẩu giấy quỳ tím hóa đỏ là H2SO4
Mẩu giấy quỳ tím không thay đổi màu là Na2SO4
c) cho nước và mẩu giấy quỳ tím vào 3 mẩu thử :
Nếu tung và có tác dụng quỳ tím hóa xanh là Na2O
Nếu tan và làm quỳ tím hóa đỏ là SO3
Không chảy là Mg
O
D. Đề thi học kì 2 Hóa 8 tất cả đáp án bắt đầu nhất
F. Tư liệu ôn thi học kì 2 hóa 8
Tài liệu vẫn còn vui vẻ ấn vào link tải phía bên dưới để tiếp tục xem tiếp.
Trên đây Vn
Doc đã giới thiệu Đề cưng cửng ôn tập học kì 2 môn hóa học lớp 8 năm 2022 - 2023 Đề cương cứng tổng vừa lòng lại kiến thức trọng tâm, câu hỏi dưới dạng trắc nghiệm với tự luận có không thiếu đáp án bám sát đít nội dung ôn thi học tập kì 2. Trải qua tài liệu này, các em học viên sẽ rứa được phần đa dạng bài xích tập cơ bạn dạng và cải thiện trong chương trình Hóa 8 học kì 2, giúp các bạn củng cố, luyện tập những dạng bài xích tập và đạt kết quả cao vào kì thi tới.
Xem thêm: Top 4 bài luận tiếng anh về các mùa trong năm bằng tiếng anh
Để chuẩn bị cho kì thi học kì 2 lớp 8 chuẩn bị tới, các em học viên cần ôn tập theo đề cương, hình như cần thực hành thực tế luyện đề để gia công quen với rất nhiều dạng đề khác nhau cũng giống như nắm được kết cấu đề thi. Chuyên mục Đề thi học tập kì 2 lớp 8 trên Vn
Doc tổng thích hợp đề thi của toàn bộ các môn, là tài liệu nhiều mẫu mã và hữu ích cho những em ôn tập cùng luyện đề. Đây cũng chính là tài liệu hay cho thầy cô tham khảo ra đề. Mời thầy cô và những em tham khảo.