Bài viết sau trình các nội dung của môn Hóa Học: chuyển đổi giữa khối lượng thể tích với lượng chất, công thức thay đổi giữa cân nặng thể tích với lượng chất, bài tập biến hóa giữa trọng lượng thể tích với lượng chất Hóa 8. Toppy sẽ hệ thống lại kỹ năng và kiến thức và hướng dẫn chúng ta làm bài xích tập đưa ra tiết. Hi vọng rằng, tài liệu này sẽ bổ ích cho chúng ta trong quá trình học tập.
Bạn đang xem: Khối lượng thể tích là gì
Chuyển thay đổi giữa trọng lượng chất với lượng chất
Chuyển đổi giữa khối lượng thể tích cùng lượng chất vào Hóa lớp 8 là bài học kinh nghiệm quan trọng. Việc thay đổi thông qua những công thức với được áp dụng trong tính toán, giải những bài tập vày vậy bạn phải thuộc lòng chúng.
Công thức
Gọi m là trọng lượng chất ( tính bằng đơn vị gam), n là lượng hóa học (hay số mol) của một chất, M là khối lượng mol hóa học (đơn vị tính gam/mol), ta bao gồm công thức biến đổi như sau:
m = n x M (gam)
Từ phương pháp trên, ta bao gồm công thức tương quan sau:
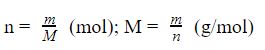

Chuyển đổi giữa khối lượng chất cùng lượng chất
Ví dụ minh họa
Tính trọng lượng của 0,5 mol CO2, biết rằng cân nặng mol CO2 là 44 g/mol.
Hướng dẫn:
Khối lượng của 0,5 mol CO2 là:
m
CO2 = 0,5 x 44 = 22 gam
1 mol phân tử khí CO2 có khối lượng là 44 gam
=> 0,5 mol phân tử khí CO2 có cân nặng a gam
=> a = 0,5 x 44 = 22 gam xuất xắc m
CO2 = 22 gam
Kết luận
Tìm khối lượng chất (m) khi vẫn biết số mol hóa học (n), thứ nhất ta tìm cân nặng mol (M) chất đó, tiếp sau áp dụng bí quyết tính: m = n x M (gam)Tìm số mol chất (n) khi đang biết cân nặng chất (m), ta triển khai tìm khối lượng mol (M), tiếp theo áp dụng phương pháp sau: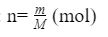
Chuyển đổi giữa thể tích chất khí với lượng hóa học (số mol)
Công thức
Gọi V là thể tích mol chất khí, n là lượng (số mol) chất khí đó, trong đk tiêu chuẩn ( nhiệt độ độ: 0 độ C, áp suất: 1 atm), ta bao gồm công thức thay đổi như sau:
V = n x 22,4 (lít)
Từ công thức trên, ta bao gồm công thức liên quan:
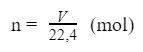

Chuyển thay đổi giữa thể tích hóa học khí và lượng hóa học (số mol)
Ví dụ minh họa
Trong điều kiện tiêu chuẩn, 0,5 mol khí CO2 rất có thể tích là bao nhiêu?
Hướng dẫn:
Ở điều kiện tiêu chuẩn, 1 mol khí chỉ chiếm 22,4 lít
=> Ở đk tiêu chuẩn 0,5 mol khí chỉ chiếm : 0,5 x 22,4 = 11,25 lít
Kết luận
Tìm số mol chất khí ta vận dụng công thức: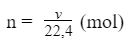
Bài tập thay đổi giữa trọng lượng thể tích với lượng hóa học Hóa 8
Qua nhì phần triết lý nêu trên, bạn cần nắm được ngôn từ sau:
1/ biết phương pháp chuyển thay đổi giữa khối lượng thể tích cùng lượng chất
2/ Biết xác định khối lượng, thể tích với lượng hóa học khi biết tin tức hai đại lượng còn lại.
Bài tập đổi khác giữa khối lượng thể tích cùng lượng chất
Bài tập biến đổi giữa trọng lượng thể tích cùng lượng hóa học Hóa 8 được giải bằng công thức biến đổi giữa cân nặng thể tích cùng lượng chất đã nêu trên. Sau đấy là bài tập áp dụng.
Bài tập 1: Hãy tính
a) Số mol của: 11,2g Fe; 32g Cu; 8,1g Alb) Thể tích khí ( trong đktc) của: 1,5 mol H2; 0,2 mol CO2; 2 mol N2c) Thể tích và số mol của các thành phần hỗn hợp khí (ở đktc) gồm: 0,88g CO2; 0,06g H2; 1,12g N2Hướng dẫn:
a) Số mol của những chất khớp ứng như sau:
nFe = 11,2/56 = 0,2 moln
Cu = 32/64 = 0,5 moln
Al = 8,1/27 = 0,3 mol
b) Thể tích khí ngơi nghỉ đktc:
VH2 = 22,4 x 1,5 = 33,6 lítVCO2 = 22,4 x 0,2 = 4,48 lít
VN2= 22,4 x 2 = 44,8 lít
c) Thể tích cùng số mol của láo hợp:
nCO2 = 0,88/44 = 0,02 mol;v
CO2 = 22,4 x 0,02 = 0,448 lítn
H2 = 0,06/2 = 0,03 mol;VH2 = 22,4 x 0,03 = 0,672 lít;n
N2 = 1,12/28 = 0,04 mol;VN2 = 22,4 x 0,04 = 0,896 lít.
Vậy số mol hỗn hợp là:
nhh = 0,02 + 0,03 + 0,04 = 0,09 (mol)
Thể tích hỗn hợp là:
Vhh = 0,448 + 0,672 + 0,896 = 2,016 (lít)
Hoặc Vhh = 0,09 . 22,4 = 2,016 (lít)
Bài tập 2: Hãy tính cân nặng (m) của rất nhiều lượng hóa học sau:
a) 0,25 mol nguyên tử N; 0,31 mol nguyên tử Cl; 5 mol nguyên tử O.
b) 0,4 mol phân tử N2; 0,5 mol phân tử Cl2; 4 mol phân tử O2
c) 0,2 mol Fe; 2,5 mol Cu; 0,4 mol H2SO4; 0,6 mol Cu
SO4
Hướng dẫn:
a) trọng lượng của nguyên tử N,Cl, O tương xứng là:
mN = 0,25 x 14 = 3,5 gm
Cl = 0,31 x 35,5 = 11,005 gm
O = 5 x 16 = 80 g
b) cân nặng của phân tử N2,Cl2, O2 tương ứng là:
mN2= 28 x 0,4 = 11,2 gm
Cl2= 71 x 0,5 = 35,5 gm
O2 = 32 x 4 = 128 g
c) cân nặng của nguyên tử Fe,Cu, hợp hóa học H2SO4 với Cu
SO4 tương xứng là:
Fe= 56 x 0,2 = 11,2 g m
Cu= 64 x 2,5 = 160 gm
H2SO4 = (2 + 32 + 64) x 0,4 = 39,2 gm
CuSO4 = (64 + 32 + 64) x 0,6 = 96 g

Chuyển thay đổi giữa khối lượng thể tích và lượng chất
Bài tập 3: cho 200g khí oxi với 187g khí cacbondioxit, cả 2 khí mọi ở đk thường 1 atm với 20o
C. Hiểu được thể tích mol khí là 24 lít . Trường hợp trộn khối lượng 2 khí trên với nhau (trong trường hợp không có phản ứng xảy ra), hỏi thể tích hỗn hợp khí nhận được là bao nhiêu?
Hướng dẫn:
Ta có:
nO2 = 200/32 = 6,25 moln
CO2 = 187/44 = 4,25 mol
Thể tích của tất cả hổn hợp khí:
Vhh = 24 x (nO2 + n
CO2) = 24 x (6,25 + 4,25) = 252 lít
Bài viết trên đây sẽ cung cấp cho mình đọc những kỹ năng cơ bạn dạng về chuyển đổi giữa khối lượng thể tích với lượng chất cùng những dạng bài xích tập tổng hợp. Hy vọng nội dung bài viết sẽ góp ích cho mình trong quá trình học tập và nghiên cứu. Chúc bạn thành công!
Giải pháp trọn vẹn giúp con lấy điểm 9-10 dễ dàng cùng Toppy
Với phương châm lấy học sinh làm trung tâm, Toppy chú trọng câu hỏi xây dựng cho học sinh một lộ trình học tập cá nhân, giúp học viên nắm vững căn bản và tiếp cận con kiến thức cải thiện nhờ khối hệ thống nhắc học, thư viện bài tập cùng đề thi chuẩn khung năng lượng từ 9 lên 10.
Kho học tập liệu khổng lồ
Kho clip bài giảng, văn bản minh hoạ sinh động, dễ dàng hiểu, lắp kết học viên vào hoạt động tự học. Thư viên bài tập, đề thi phong phú, bài tập trường đoản cú luyện phân cấp các trình độ.Tự luyện – trường đoản cú chữa bài bác giúp tăng tác dụng và rút ngắn thời hạn học. Phối kết hợp phòng thi ảo (Mock Test) gồm giám thị thật để sẵn sàng sẵn sàng và toá gỡ nỗi sợ hãi về bài thi IELTS.

Học online thuộc Toppy
Nền tảng tiếp thu kiến thức thông minh, ko giới hạn, khẳng định hiệu quả
Chỉ cần điện thoại cảm ứng thông minh hoặc thiết bị tính/laptop là chúng ta cũng có thể học bất kể lúc nào, bất cứ nơi đâu. 100% học viên trải nghiệm tự học cùng TOPPY gần như đạt kết quả như mong muốn muốn. Các kỹ năng cần triệu tập đều được nâng cao đạt kết quả cao. Học lại miễn giá tiền tới lúc đạt!
Tự động tùy chỉnh cấu hình lộ trình học tập tập tối ưu nhất
Lộ trình học tập cá thể hóa cho mỗi học viên dựa vào bài kiểm tra đầu vào, hành vi học tập, kết quả luyện tập (tốc độ, điểm số) trên từng đơn vị chức năng kiến thức; tự đó tập trung vào các kỹ năng còn yếu ớt và hầu hết phần kiến thức và kỹ năng học viên chưa cố gắng vững.
Trợ lý ảo và cố vấn tiếp thu kiến thức Online đồng hành cung cấp xuyên suốt quy trình học tập
Kết phù hợp với ứng dụng AI nói học, reviews học tập thông minh, chi tiết và đội ngũ hỗ trợ thắc mắc 24/7, góp kèm cặp và đụng viên học viên trong suốt quy trình học, tạo thành sự lặng tâm phó thác cho phụ huynh.
Thể tích là gì? fan ta sử dụng đơn vị chức năng nào nhằm đo thể tích? phương pháp tính thể tích như nào? toàn bộ những câu vấn đáp đó sẽ tiến hành giải đáp ví dụ trong bài viết dưới đây. Hãy thuộc shthcm.edu.vn mày mò nhé!
Thể tích là gì?
Thể tích là gì? Đây là thắc mắc của khá nhiều học sinh hiện nay. Rất có thể hiểu một cách đối chọi giản, thể tích của một đồ vật là lượng không gian mà một đồ gia dụng đó chiếm. Đặc biệt, bạn cần phân biệt thân thể tích với dung tích. Đây là nhì khái niệm hoàn toàn khác nhau.
Cụ thể, bề mặt là kĩ năng chứa đựng về tối đa của một thiết bị nào đó. Ví dụ như dung tích của một mẫu cốc là năng lực chứa nước tối đa của dòng cốc đó. Thể tích của một đồ dùng được cam kết hiệu là V. Chúng ta cần để ý viết V (in hoa) để sáng tỏ với v (thường) là cam kết hiệu của vận tốc.

Đơn vị đo thể tích
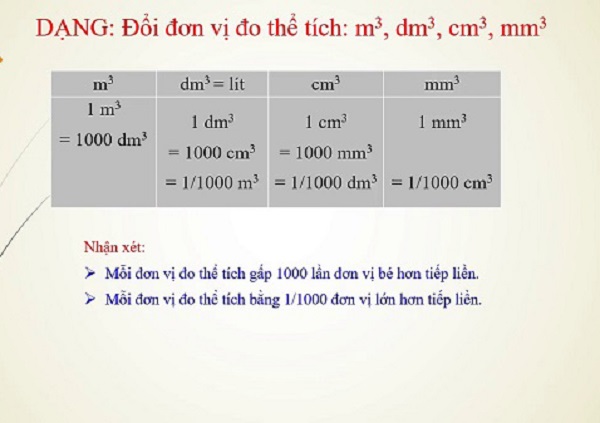
Đơn vị thể tích được biết thêm tới thịnh hành đo là mét khối, ký kết hiệu (m^3) cùng lít bao gồm ký hiệu l.
Xem thêm: Top Ứng Dụng Chuyển Hình Ảnh Thành Tranh Vẽ Trên Điện Thoại, Chuyển Ảnh Chụp Thành Tranh Vẽ Online
Ngoài (m^3), người ta hoàn toàn có thể dùng những đơn vị bé dại hơn như (cm^3) hay (dm^3). Giống như vậy, bên cạnh lít, bạn ta có thể dùng đơn vị đo nhỏ tuổi hơn là mililít, ký kết hiệu ml hoặc sử dụng đơn vị lớn hơn là megalít, ký hiệu ML. Các bạn cần xem xét kỹ để sáng tỏ sự khác biệt về ký kết hiệu thân hai đại lượng này kị nhầm lẫn.
Bảng đơn vị chức năng đo thể tích lít
Mối contact giữa các đơn vị đo như sau?
1 lít = (1 dm^3)1 ml = (1 cm^3)1m3 = (1000 dm^3)= (1000000 cm^3)1 lít = 1000ml.Dưới đây là bảng đơn vị chức năng đo thể tích lít thường được sử dụng với các chất lỏng như nước, xăng, dầu…
Các phương pháp tính thể tích
Sau khi đã tìm hiểu xong thể tích là gì, họ cần nắm rõ những công thức đo thể tích nhằm việc thực hành thực tế và áp dụng tốt hơn.
Công thức tính thể tích thiết bị lý
Trong đồ gia dụng lý, bí quyết tính thể tích được xác minh như sau;
(V = fracmD) trong đó: V thể tích, m là khối lượng của vật cùng D là khối lượng riêng của hóa học tạo thành đồ dùng đó.
Dựa vào cách làm trên, ta cũng hoàn toàn có thể xác định được quan hệ tỉ lệ thuận giữa thể tích và khối lượng của trang bị đó.
Cách tính thể tích hóa học lỏng
Cách tính thể tích nước hay cách tính thể tích của hóa học lỏng sẽ nhờ vào vào vật cất số chất lỏng đó. Nếu vật cất chất lỏng là hình trụ thì ta cần vận dụng công thức tính thể tích hình trụ để tính toán. Giống như nếu chính là hình lập phương xuất xắc hình vỏ hộp chữ nhật.
Do đó, sẽ không có một công thức tính thể tích chất lỏng ví dụ mà phương pháp tính thể tích nước nói riêng cùng tính thể tích nói phổ biến sẽ dựa vào vào thiết bị chứa.
Một số công thức tính thể tích những hình phổ biến
Thể tích hình lập phương: (V = a^3) cùng với a là độ nhiều năm cạnh của hình lập phương. Thể tích hình cầu: (V = frac43 Pi r^3) trong những số đó r là phân phối kính.Vậy là chúng ta đã tìm hiểu được thể tích là gì, đơn vị chức năng đo thể tích và những công thức tính thể tích. Đây là một phần quan trọng, lúc học bạn cần để ý và ghi nhớ, nhất là cách đổi những đơn vị đo thể tích. Hãy mang lại với shthcm.edu.vn nhằm hiểu thêm thể tích là gì cũng như khám phá nhiều kỹ năng và kiến thức hay và có lợi hơn nữa nhé!